INTRODUCCIÓN
La epilepsia es una enfermedad que se caracteriza por una predisposición crónica a la aparición de crisis epilépticas, la cual se acompaña de consecuencias neurobiológicas, cognitivas, psicológicas y sociales1.
Según los datos publicados por la Organización Mundial de la Salud (OMS), aproximadamente 50 millones de personas padecen epilepsia a nivel mundial, con una prevalencia a lo largo de la vida de 7,6 por cada 1.000 personas2,3, estimándose que el 70% de las personas con epilepsia podrían vivir sin crisis si se diagnosticaran y trataran adecuadamente.
La epilepsia aumenta el riesgo de mortalidad prematura4 y condiciona de manera significativa la calidad de vida de las personas que la padecen, situándose como la segunda enfermedad neurológica en años de vida potencialmente perdidos o vividos con discapacidad. Los elementos que suponen una mayor limitación en la calidad de vida son el género, con mayor efecto en las mujeres, la alta frecuencia de crisis, la necesidad de politerapia, la comorbilidad psiquiátrica y la situación de desempleo secundaria5.
El estudio y tratamiento de la epilepsia supone un reto cada vez mayor. La aparición de nuevas moléculas para su tratamiento, la mejora de las técnicas diagnósticas y terapéuticas, así como el descubrimiento exponencial de variantes genéticas relacionadas con el desarrollo de la enfermedad, han aumentado significativamente la complejidad para la toma de decisiones individual de cada paciente. Las variables posibles que se deben considerar de cara a optimizar el tratamiento, entorpecidas por las limitaciones burocráticas del propio sistema, propician que el profesional clínico deba apoyarse en sistemas externos de análisis de datos clínicos y previsión de resultados.
Ante esta necesidad, la posibilidad de utilizar técnicas de análisis de datos mediante inteligencia artificial (IA) ha supuesto una revolución en la medicina moderna. Las técnicas de IA con mayor repercusión (Fig. 1) se centran en machine learning (ML) o aprendizaje automático, y dentro de este, en deep learning o aprendizaje profundo, que se fundamenta en redes neuronales capaces de realizar procesos de abstracción y análisis complejos6,7. El desarrollo tecnológico actual, con la comercialización de dispositivos de análisis portátil (wearables), permite a estas tecnologías aprovechar el procesamiento de señales para dinamizar el estudio de la epilepsia con una mayor autonomía del paciente. En esta revisión se exponen ejemplos de tecnologías basadas en IA que suponen ya el presente y el futuro de la atención al paciente epiléptico.
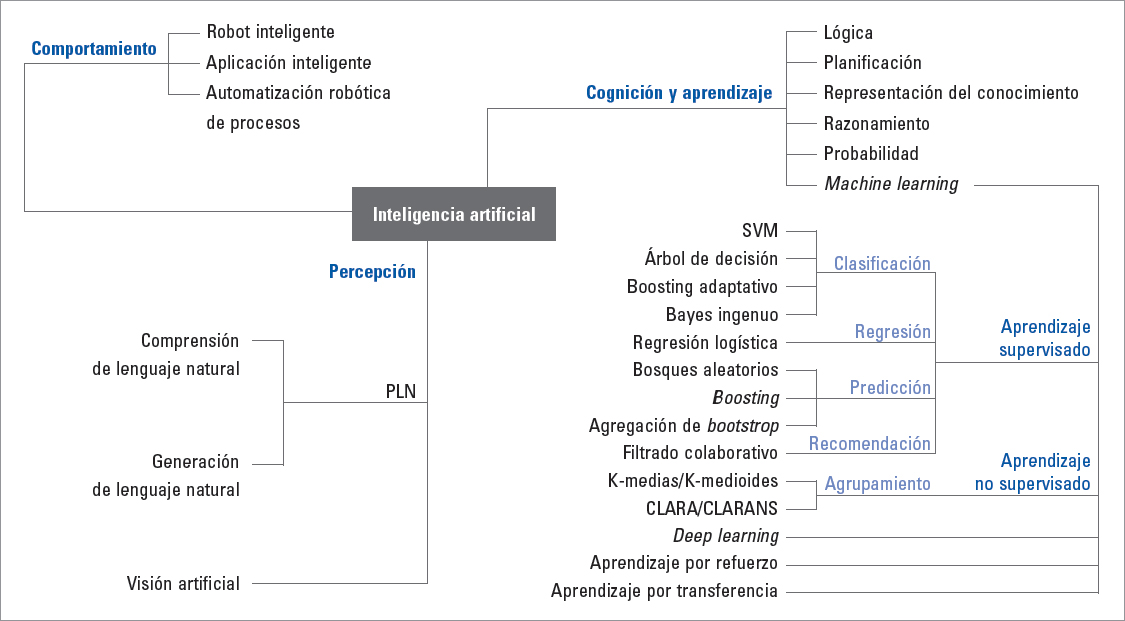
FIGURA 1. Áreas de desarrollo de la inteligencia artificial (adaptada de Wang et al., 20218). SVM: support vector machines (máquinas de vector de soporte); PNL: procesamiento del lenguaje natural.
RESPUESTA A TRATAMIENTO
La base del tratamiento en todo paciente epiléptico es el uso de fármacos antiepilépticos (FAE) o medicamentos anticrisis3. En la práctica clínica diaria se deben valorar las comorbilidades, el subtipo de epilepsia, los datos clínicos, así como los rasgos únicos y las vivencias del paciente con el objetivo de confeccionar para él una pauta idónea. De la adecuación del tratamiento dependerá en gran medida la respuesta del control de crisis, así como el impacto en la calidad de vida del paciente, por lo que es uno de los elementos donde las tecnologías de IA se han focalizado.
Existen estudios destinados a calcular las tasas de respuesta esperadas a determinados FAE en función de las características clínicas y la respuesta electroencefalográfica al tratamiento. Por ejemplo, se analizó una cohorte de 23 pacientes en tratamiento con levetiracetam, uno de los fármacos más utilizados, con un resultado de predicción de la respuesta clínica del 75-80% según su área bajo la curva (area under the curve, AUC)8. Estos modelos de ML suponen los primeros pasos para optimizar la farmacorrespuesta, mejorando su efectividad al desarrollar árboles de decisión más complejos que incluyan un gran número de variables que permitan realizar una priorización entre los distintos fármacos, siendo necesario extender su estudio al resto de las moléculas.
La aplicación de la teoría de grafos en sistemas de redes neuronales constituye un campo con alta aplicabilidad a nivel clínico9. La implementación de estas tecnologías de IA en el análisis de estudios de resonancia magnética funcional (RMf) ha permitido cuantificar la efectividad de distintos FAE, además de objetivar un efecto positivo en redes y estructuras cerebrales concretas10. En este estudio10 usaron un modelo de ML denominado máquinas de vectores de soporte o de soporte vectorial (support vector machines, SVM), logrando una tasa de clasificación (diferenciar pacientes en los que el tratamiento es efectivo de los que no) del 84,22% (sensibilidad del 78,76%, especificidad del 89,65% y AUC de 0,96). La limitación del estudio radica en su tamaño muestral, 35 pacientes y controles, y en su aplicación, exclusiva a pacientes pediátricos con epilepsia de ausencias. Pese a ello, la generalización de su uso supondría una enorme utilidad a nivel clínico y con importantes aplicaciones a nivel traslacional, ahondando en el conocimiento de la fisiopatología de la epilepsia.
Algunos modelos de predicción de ML han desarrollado sistemas de estimación de respuesta a FAE mediante la introducción de datos clínicos y estudios genéticos de los pacientes11. En un estudio se estableció una predicción de respuesta a brivaracetam con una AUC de 0,76 cuando se aplicó el modelo conjunto (datos clínicos más genéticos)11. Las simulaciones que analizaron cada categoría de información por separado, clínica o genética, no mostraron diferencias en los resultados del modelo clínico frente al genético, y ninguno de ambos fue superior a la estimación conjunta, confirmando que el modelo que aúna ambas fuentes logra unas predicciones significativamente más sólidas. Las variables de más peso en la predicción fueron la respuesta previa a levetiracetam y la localización del foco epileptógeno. En estos sistemas de predicción, sin embargo, el sesgo en la información clínica y el desconocimiento de muchas de las variables genéticas patogénicas limitan su efectividad.
Estos hallazgos refuerzan el paradigma establecido en los modelos de IA mediante el cual la diversificación de las fuentes de información, asegurando una recogida adecuada de esta, logran establecer modelos predictivos más objetivos y de mayor aplicabilidad clínica.
ELECTROENCEFALOGRAFÍA
Los estudios de electroencefalografía (EEG) comenzaron a utilizarse en humanos desde 1920 gracias al trabajo pionero del neurólogo y psiquiatra Hans Berger. Desde entonces, nuestro conocimiento en la electrofisiología del cerebro se ha ampliado enormemente, particularmente en el estudio de la epilepsia, llegando a suponer una herramienta indispensable para el diagnóstico y manejo de la enfermedad. Con el aumento de la demanda de estudios prolongados, de monitorización urgente y el incremento de casos de difícil valoración, los clínicos formados en interpretación del EEG han experimentado una responsabilidad y una sobrecarga asistencial crecientes, por lo que han surgido herramientas complementarias cuyo objetivo es facilitar estas tareas.
En los últimos años han aparecido distintos modelos de IA orientados al análisis EEG con el objeto de acortar los tiempos necesarios para su interpretación por parte de los profesionales entrenados, e incluso automatizar completamente el proceso. Tres de estos modelos de IA son Encevis, SpikeNet y Persyst, siendo la tendencia de aparición de nuevos softwares cada vez más acusada.
Se ha realizado un estudio comparativo entre modelos de análisis de registros breves de EEG estandarizado (unos 20 minutos por registro) aplicando sistemas de análisis automatizado, análisis híbrido (selección de eventos por parte de la IA con posterior lectura por el especialista) y el modelo tradicional de lectura del registro en su totalidad12. De los tres, el sistema automatizado, pese a su elevada sensibilidad, presentaba unas tasas de especificidad demasiado bajas para su implementación según los estándares actuales, que buscan evitar el sobrediagnóstico13–15. El modelo híbrido presentaba tasas de sensibilidad similares con una mejoría significativa de la especificidad, logrando una precisión global de: Encevis 93,33%, SpikeNet 76,67% y Persyst 86,67%, similar a la del modelo tradicional (83,33%) (Tabla 1). Es importante destacar que el tiempo requerido para la interpretación de los estudios fue significativamente menor con el sistema híbrido, logrando reducciones de entre el 26 y el 91%.
TABLA 1. Comparativa de la sensibilidad, especificidad, precisión y tiempo de análisis, con sus intervalos de confianza al 95%, entre los distintos modelos y cada uno de los softwares utilizados
| Modelo | Sensibilidad | Especificidad | Precisión | Tiempo |
|---|---|---|---|---|
| Tradicional | ||||
| 93,33% (77,93-99,18) | 73,33% (55,11-87,72) | 83,33% (71,48-91,70) | 160 s/registro (146-172 s) | |
| Automatizado | ||||
| Encevis | 96,67% (82,78-99,92) | 16,67% (5,64-34,72) | 56,67% (43,24-69,41) | Automático |
| SpikeNet | 66,67% (47,19-82,71) | 63,33% (43,86-80,07) | 65% (51,6-76,87) | |
| Persyst | 100% (88,43-100) | 3,33% (0,08-17,22) | 51,67% (38,39-64,77) | |
| Híbrido | ||||
| Encevis | 93,33% (77,93-99,18) | 93,33% (77,93-99,18) | 93,33% (77,93-99,18) | 118 s/registro (103-134 s) |
| SpikeNet | 56,67% (37,43-74,54) | 96,67% (82,78-99,92) | 76,67% (63,96-86,62) | 14 s/registro (11-16 s) |
| Persyst | 76,67% (57,72-90,07) | 96,67% (82,78-99,92) | 86,67% (75,41-94,06) | 59 s/registro (50-67 s) |
|
Adaptada de Kural et al., 202212. |
||||
Las potenciales aplicaciones de estas herramientas de interpretación por IA son incuestionables, pero es necesario demostrar la escalabilidad de estos modelos a registros prolongados y a dispositivos EEG de alta densidad o de áreas extendidas. La futura irrupción de softwares más complejos quizá torne la balanza hacia un sistema con mayor nivel de automatización.
La IA también puede suponer un cambio de paradigma en el manejo precoz de los pacientes con riesgo de epilepsia. La susceptibilidad a padecer crisis depende de un sinfín de factores, lo que con frecuencia hace difícil adecuar la mejor actitud terapéutica a cada situación.
En atención intrahospitalaria es vital establecer el riesgo de padecer crisis epilépticas, y para ello se ha desarrollado una escala de riesgo, 2HELPS2B16, que, mediante la introducción de un único dato clínico (haber padecido crisis epilépticas) y la confirmación de una serie de grafoelementos habituales en la monitorización EEG, permite establecer el riesgo de padecer crisis con un AUC de 0,819. Sin embargo, existen limitaciones para la aplicación de esta escala: no todos los centros pueden realizar monitorizaciones EEG; todos los pacientes incluidos contaban con un registro continuado de al menos 6 horas, no pudiéndose validar la escala en estudios de menor duración.
También se han desarrollado modelos de IA que permiten establecer el riesgo de padecer una epilepsia generalizada idiopática o genética mediante técnicas de machine learning aplicadas a registros de EEG. Con el método extreme gradient boosting se ha logrado una precisión del 98% en la identificación de epilepsia generalizada idiopática o genética frente a controles sanos17.
La gran disponibilidad de datos digitalizados de los registros de EEG explica que este campo haya experimentado un mayor crecimiento durante los primeros años de aplicación de la IA en epilepsia. Ya se dispone de los primeros resultados comerciales y es probable que durante los próximos años sigan apareciendo más y mejores soluciones que permitan optimizar el diagnóstico y el tratamiento de la epilepsia.
MUERTE SÚBITA INESPERADA EN LA EPILEPSIA
La muerte súbita inesperada en la epilepsia (sudden unexpected death in epilepsy, SUDEP) es la principal causa de mortalidad asociada a la epilepsia, así como la segunda causa neurológica de pérdida de años de vida18–20. Habitualmente, la SUDEP se presenta durante la noche y sin observadores21, siendo su riesgo mayor en las crisis generalizadas o bilaterales tónico-clónicas (CGTC)22.
Con el objetivo de prevenir los episodios de SUDEP se han desarrollado modelos de IA que han incluido factores potencialmente predictores derivados de registros EEG intercríticos23 y del electrocardiograma, como la variabilidad de la frecuencia cardiaca24, comparándolos con controles. De los modelos planteados, el que obtuvo mejores resultados ha sido el modelo de regresión logística, con una AUC de 0,77 para la predicción de pacientes con riesgo de SUDEP. Las limitaciones principales de este estudio fueron su tamaño muestral reducido, el uso de registros EEG y electrocardiográficos breves y no haber valorado datos de supresión EEG postictal. Los resultados no se validaron en otras poblaciones.
Las nuevas tecnologías están aportando enfoques no explorados en los modelos de prevención, como el sistema denominado Nelli25. Se trata de una herramienta de detección automatizada de crisis motoras nocturnas que emplea grabaciones en directo de audio y vídeo de los pacientes y las analiza con IA25. El objetivo principal es el diagnóstico de crisis hipermotoras complejas y CGTC nocturnas, las que más se relacionan con SUDEP. El objetivo secundario es identificar crisis motoras nocturnas simples. Nelli se comparó con la interpretación del vídeo-EEG por un experto. La sensibilidad del sistema Nelli para la detección de crisis mayores fue del 93,7% (el 100% de las CGTC y el 80% de las crisis hipermotoras complejas). En las crisis motoras simples, la sensibilidad disminuía hasta un 8,3%. Pese a lo positivo de estos resultados, cabe destacar que el sistema presentó una tasa de falsos positivos de 0,16 por hora, siendo detectadas en el 63% de los sujetos.
La predicción de SUDEP se puede nutrir en el futuro de otras fuentes de datos con la incorporación de parámetros como los derivados de la monitorización respiratoria y la actividad electrodérmica, así como de otros sistemas tecnológicos que probablemente aumentarán la precisión de estos modelos.
NEUROIMAGEN
La neuroimagen, además de ser uno de los pilares diagnósticos en epilepsia, está experimentando progresos en materia terapéutica al permitir planificar abordajes quirúrgicos avanzados. La resonancia magnética estructural (RM) permite determinar en algunos casos la etiología de la epilepsia26, posibilitando su tratamiento quirúrgico cuando esté indicado27.
La esclerosis hipocampal (EH) es la principal variante estructural que se relaciona con la epilepsia de lóbulo temporal mesial. Un método de análisis de regresión (LASSO) con SVM ha permitido discernir la presencia de EH en la RM con un AUC de 0,85, precisión mayor que la de observadores entrenados, lo que permite evitar retrasos diagnósticos28.
En pacientes con semiología sugestiva de epilepsia del lóbulo temporal mesial y estudios de RM negativos para EH se aplicó un modelo de IA que aunaba ambas fuentes de información (clínica y radiológica), logrando una reclasificación de estos pacientes con una precisión del 88%27. Aunque la correcta detección de EH es vital en epilepsia, estos modelos se ven limitados por su aplicación específica a dicha entidad, obviando alteraciones en el resto del parénquima.
Otra entidad de indiscutible relevancia en epilepsia es la displasia cortical focal (DCF), que constituye la causa más común de epilepsia refractaria en la infancia y la segunda en adultos29. Se entrenó una red neuronal convolucional (convolutional neural network, CNN) para distinguir diferencias en la simetría y la densidad visualizada en la interfase entre sustancia blanca y gris, logrando una precisión diagnóstica del 88% para DCF30. Otro sistema, basándose en métodos de SBM (surface-based morphometry)31 y una red neural no lineal, analizó una serie de parámetros extraídos de una reconstrucción 3D cortical, logrando identificar DCF con un AUC de 0,7532. La principal limitación de estos modelos es la variabilidad de la calidad de los estudios en función de las RM disponibles en cada centro, así como la necesidad de un software adecuado supervisado por un experto con el que realizar el posprocesado de datos.
Para dar respuesta a las limitaciones de los modelos previos, Gill et al. desarrollaron un modelo de CNN que evitaba la necesidad de reconstrucción de superficies y realizaba su análisis directamente en vóxeles, pudiendo implementar el modelo en centros externos con una media de sensibilidad del 91%33. Otro modelo de CNN ha demostrado a nivel multicéntrico una sensibilidad del 85% para la detección de DCF en pacientes con estudio RM negativo y del 93% para todos los pacientes de la serie. La principal limitación en su aplicabilidad es su tasa de falsos positivos y la necesidad de contar con un sistema adecuado de procesado34.
La RMf está proporcionando datos que apoyan que la etiopatogenia de la epilepsia radica en una alteración de determinadas redes neuronales35. Con técnicas de ML aplicadas a la RMf de reposo se han podido distinguir patrones específicos de epilepsia temporal mesial y clasificar entre pacientes sanos y epilépticos con una precisión del 98% y una sensibilidad del 100%, confirmando además circuitos concretos que manifiestan una clínica específica. Otras aplicaciones de estas técnicas son confirmar la lateralidad del foco epiléptico36 y evaluar la lateralidad del lenguaje37 antes de una cirugía.
El ML también se ha aplicado a la tomografía por emisión de positrones (PET) con fluorodesoxiglucosa en el estudio de la lateralización y localización de foco epiléptico38,39, sin claras evidencias de una mejor precisión que otras alternativas descritas. En los últimos años se ha ampliado su uso a la predicción de crisis posquirúrgicas40,41.
Asimismo, el uso conjunto de PET y RM tiene un efecto sinérgico a la hora de localizar DFC, logrando en los modelos ensayados una precisión del 93 frente al 82% de solo RM, con la limitación de un tamaño muestral bajo42.
Por el momento, estos estudios tienen tamaños muestrales pequeños y carecen de una adecuada validación externa, pero se intuye la irrupción del PET como técnica de diagnóstico y manejo en epilepsia. La inmensa disponibilidad de datos de neuroimagen permitirá el desarrollo exponencial de modelos de IA en el futuro cercano.
WEARABLES
El uso de wearables (dispositivos portátiles, llevables, ponibles o vestibles) está en auge en la sociedad43. Este interés pronto alcanzó al ámbito sanitario, especialmente al campo de la epilepsia. El principal interés de su empleo en epilepsia radica en que los diarios de crisis son una fuente de información poco fiable a la hora de tomar decisiones clínicas44, por lo que obtener un método de cuantificación objetiva de las crisis y de respuesta a tratamientos se ha hecho indispensable.
Respondiendo a esta necesidad se han desarrollado numerosos dispositivos de registro (Fig. 2) y publicado trabajos que los respaldan45, la mayor parte con sistemas de validación poco robustos46. Para estandarizar este proceso se ha propuesto un sistema basado en la evaluación de los elementos indispensables para la correcta detección de crisis (sujetos, registros, análisis de datos, alarmas y estándar de referencia)47. Existen cinco fases de validación (0-4), englobando la fase 3 los estudios con evidencia robusta y la fase 4 aquellos que han sido evaluados en práctica clínica real.

FIGURA 2. Dispositivos wearables comercializados. Superior, de izquierda a derecha: Empatica, Ictal Care, Epilog. Inferior, de izquierda a derecha: Dialog, Nightwatch, mjn-SERAS. Marcas registradas (fuentes: empatica.com, dtu.dk, inceptivemind.com, artefactgroup.com, nightwatchepilepsy.com y mjn.cat).
Aunque las crisis se pueden detectar mediante EEG de superficie con una sensibilidad entre el 75 y el 90%, su extrapolación a dispositivos portátiles de baja concentración de electrodos no se ha generalizado debido a la marcada disminución de la precisión de estos dispositivos48.
En la actualidad, los wearables que han demostrado un rendimiento significativo son aquellos que no se basan en la utilización del registro EEG46, sino en algoritmos centrados en EMG (electromiograma) de superficie49 y acelerómetros50, aunque exclusivamente en CGTC.
Se ha desarrollado un brazalete que dispone de un acelerómetro que permite detectar CGTC con una sensibilidad del 90%, una tasa de falsa alarma de 0,2 por día y una latencia media de 55 segundos50. Otro dispositivo de EMG de superficie a nivel de bíceps ha demostrado una sensibilidad del 94% en la detección de CGTC, con una tasa de falsa alarma de 0,7 por día y una latencia media de detección de 9 segundos51.
La irrupción de estos dispositivos en el ámbito de la epilepsia supondrá un cambio en el manejo de los pacientes, permitiendo su mayor autonomía y una toma de decisiones más objetiva por parte del clínico. El futuro de los wearables en epilepsia pasa por la inclusión de tecnologías de ML en los dispositivos de registro alternativos al EEG, así como por el desarrollo de sistemas de EEG de baja densidad de electrodos más precisos.
CONCLUSIONES
La IA es una herramienta que, asociada a las técnicas tradicionales, se está introduciendo en la práctica clínica de la epilepsia a todos los niveles: prevención, diagnóstico, tratamiento, seguimiento e investigación. La formación y el empoderamiento tecnológico por parte del neurólogo y otros profesionales de la salud son claves para aprovechar todo este potencial.
Los principales objetivos de la IA y los dispositivos que en ella se basan son el beneficio directo para el paciente, la liberación de la sobrecarga a la que están sometidos los profesionales y, finalmente, poder disponer de tiempo para dedicarlo a quien nos pide ayuda, revitalizando así la relación paciente-médico, su cercanía y otros valores clásicos de la medicina.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
CONFLICTO DE INTERESES
Los autores no comunican conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
Los autores declaran que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este trabajo no aparecen datos de pacientes.
Uso de inteligencia artificial generativa
Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni en la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.