INTRODUCCIÓN
Hoy en día, las enfermedades neurológicas siguen presentando en todo el mundo un incremento tanto en prevalencia como en incidencia, y suponen la primera causa de discapacidad ajustada por años de vida y la segunda de mortalidad1. Según la Federación Española de Daño Cerebral, de acuerdo con la Encuesta de discapacidad, autonomía personal y situaciones de dependencia del Instituto Nacional de Estadística de abril de 2022, en nuestro país hay más de 435.400 personas con daño cerebral sobrevenido (DCS), lo que supone un incremento del 3,65% con respecto a la encuesta anterior, de 2008. La causa principal de DCS sigue siendo el ictus, con un 84%, seguido del traumatismo craneoencefálico, secuelas posquirúrgicas, encefalopatía hipóxico-isquémica y otras encefalitis o encefalopatías, con un 16%2.
Muchas de estas enfermedades conllevan numerosas secuelas, tanto funcionales como cognitivas, que pueden suponer una gran limitación para volver al estilo de vida previo y con un coste sociosanitario asociado importante. Una adecuada intervención neurorrehabilitadora temprana puede posibilitar que la recuperación sea importante y, a la postre, que el paciente consiga, pese a las secuelas definitivas, una ganancia de capacidad de adaptación a las actividades básicas e instrumentales de la vida previa al DCS.
¿QUÉ ES LA NEURORREHABILITACIÓN?
La Organización Mundial de la Salud define la neurorrehabilitación como un proceso activo mediante el que los individuos con alguna lesión o enfermedad neurológica pueden alcanzar la mejor recuperación integral posible que les permita su desarrollo físico, mental y social de la mejor forma, para integrarse a su ámbito vital de la manera más apropiada3.
Las intervenciones de neurorrehabilitación se han disparado desde el año 2000 gracias a un cambio en el paradigma de su atención neurológica desde mediados del siglo XX, dejando de suponer que el efecto de una lesión cerebral sobre la función, la actividad y la participación es permanente, para centrarse en el potencial regenerativo del cerebro y su reorganización dinámica meses e incluso años después del DCS. Este cambio de mentalidad conllevó un impulso de la investigación traslacional para definir las condiciones en las que se potencia la recuperación cerebral, derivando en la necesidad de una estimulación controlada e intensiva de las redes cerebrales dañadas mediante distintas herramientas de neuromodulación y reparación neuronal4,5.
La neurorrehabilitación requiere un proceso asistencial complejo en el que el especialista debe identificar las alteraciones y guiar los fenómenos de la plasticidad intrínseca del sistema nervioso para minimizar sus repercusiones y maximizar la recuperación, prevenir las complicaciones sistémicas y neurológicas propias de la evolución tras el daño del sistema nervioso y conseguir la mayor autonomía funcional posible física, cognitiva y conductual. También deben potenciarse las capacidades preservadas, de manera que se posibilite la mejor reinserción social de la persona a su entorno habitual6.
En las últimas décadas se ha experimentado un claro avance sociosanitario en la atención neurorrehabilitadora al DCS, tanto en España como en otros países. Sin embargo, aún queda un largo camino por recorrer para conseguir un modelo de atención continuada (fases aguda, subaguda y crónica). Los resultados del Atlas del ictus en España, publicado en 2019 por el Grupo de Estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología, destacan que el 37,3% de los pacientes supervivientes de un ictus perciben su estado de salud como regular y el 36,5% como malo o muy malo, el 62,4% refieren tener problemas de movilidad básicos y el 59,1% dificultades para realizar sus actividades cotidianas7.
MODELO DE TRABAJO EN UN CENTRO NEURORREHABILITADOR
El proceso de la neurorrehabilitación requiere el trabajo de un equipo interdisciplinario muy especializado, convenientemente entrenado y formado por diferentes profesionales (Tabla 1), que permita un manejo integral de la persona afectada con la adecuada combinación de las técnicas convencionales y la introducción de las nuevas tecnologías (NNTT)8. En este modelo de atención, el neurólogo cumple un papel fundamental, pues su especial formación en neuroanatomía y su conocimiento sobre la fisiopatología neurológica y la neurofarmacología resultan cruciales para abordar las complicaciones propias de estos pacientes, manejando de la mejor manera posible los efectos beneficiosos de las intervenciones farmacológicas y no farmacológicas disponibles, y garantizando así no solo el proceso neurorrehabilitador más adecuado en cada caso, sino también el conocimiento y la pericia necesarios para la toma de decisiones en aspectos complejos de los ámbitos clínico, investigador, ético y legal, muy habituales en este contexto.
TABLA 1. Equipo interdisciplinario en una unidad de neurorrehabilitación
| Médicos | Terapeutas | Otros profesionales |
|---|---|---|
| Neurólogos | Fisioterapeutas | Nutricionistas |
| Médicos rehabilitadores | Terapeutas ocupacionales | Enfermeros |
| Médicos internistas | Logopedas | Técnicos auxiliares |
| Psiquiatras | Neuropsicólogos | Farmacéuticos |
| Neurofisiólogos | Psicólogos clínicos | Trabajadores sociales |
| Neurocirujanos | Musicoterapeutas | Educadores |
| Digestólogos | Bioingenieros | |
| Urólogos | Informáticos | |
| Traumatólogos | ||
| Cirujanos generales | ||
| Otros especialistas |
El desarrollo del conocimiento científico en el campo de la neurorrehabilitación ha conllevado la participación directa y constante de profesionales de otras ramas del conocimiento, como informáticos, físicos y bioingenieros, que se han incluido en el equipo interdisciplinario para el adecuado proceso aplicativo de NNTT como la robótica, las interfaces cerebro-máquina y las técnicas de estimulación cerebral y medular no invasivas e invasivas9.
Según la Sociedad Española de Neurorrehabilitación, estos procesos deben llevarse a cabo dentro de unidades clínico-asistenciales especializadas, reconocidas como unidades de neurorrehabilitación10. Estas unidades, debidamente adheridas a un sistema de atención sanitaria continuada, abarcan desde la atención en etapas subagudas del DCS (rehabilitación neurológica en un medio hospitalario que permita, dependiendo de la complejidad del caso, atender la posible comorbilidad emergente mientras se producen los procesos de neuromodulación y reparación neuronal) hasta el posterior manejo ambulatorio con rehabilitación de mantenimiento y la adecuada reinserción social, familiar y laboral de la persona11.
LAS NUEVAS TECNOLOGÍAS EN LA NEURORREHABILITACIÓN
El uso de las NNTT en neurorrehabilitación está teniendo una rápida expansión, tanto en investigación como en sus aplicaciones clínicas. En los años 1990, a partir de investigaciones en modelos animales con lesión medular de recuperación funcional con cintas de marcha y sistemas de soporte corporal, empezaron a diseñarse las primeras aplicaciones rudimentarias de cintas de marcha con soporte de peso para entrenamiento locomotor en sujetos que habían sufrido un ictus o daño medular. Surgió así un creciente interés por analizar la fisiología de la marcha y generar los primeros modelos robóticos con control de posicionamiento mientras se lleva a cabo un entrenamiento locomotor. Este es el inicio de la robótica y de la aplicación progresiva de las NNTT en neurorrehabilitación12.
Expansión de un nuevo modelo de trabajo tras la pandemia de COVID-19
Sin embargo, a pesar de la rápida expansión y el reconocimiento de la aportación de las NNTT en esta área de la medicina, muchos profesionales aún la veían como una herramienta que debía ser valorada a largo plazo en la práctica diaria en el paciente con DCS. A partir de la pandemia de COVID-19 en el año 2020 surgió la necesidad de adaptarse a las dificultades de interacción social y mantener una terapia lo más completa posible, espoleando la incorporación de la tecnología en los centros de neurorrehabilitación según las recomendaciones entonces publicadas13.
España, uno de los países más castigados por la pandemia en Europa, no fue una excepción, y la neurorrehabilitación se vio gravemente afectada. Muchos centros de atención neurorrehabilitadora de nuestro país, públicos y privados, tuvieron una disminución en el número de ingresos tanto hospitalarios como ambulatorios, y quienes ingresaban lo hacían con mayor tiempo transcurrido entre el DCS y el inicio de la rehabilitación, mayor gravedad de las lesiones y mayor grado de secuelas. Además, los protocolos de actuación para su correcta atención, respetando las medidas de bioseguridad implantadas, requirieron adaptar las instalaciones y los recursos, utilizar maquinaria robótica en la rehabilitación motórica para evitar la interacción terapeuta-paciente, llevar a cabo un mayor apoyo psicológico y procurar altas médicas más tempranas, fomentando la rehabilitación de mantenimiento ambulatoria de los pacientes en su propio domicilio mediante telerrehabilitación14,15. Todas estas aplicaciones de nuevos recursos en la rehabilitación neurológica fueron muy bien aceptadas por los profesionales y por los pacientes16.
Telerrehabilitación
Esta herramienta de telemedicina permite la rehabilitación a distancia del paciente, tanto motora, con la interacción del terapeuta con el paciente mediante plataformas dotadas de videocámara, como cognitiva, con el uso de programas específicos, interacción con videojuegos y otros recursos, como la realidad virtual. Esta modalidad terapéutica no solo permite el trabajo en directo (síncrono), sino también en diferido (asíncrono) con tareas habituales del paciente en su rutina diaria, pudiendo llevarse a cabo un seguimiento evolutivo a distancia gracias al análisis que los mismos programas hacen de los resultados del paciente.
Los estudios de investigación sobre estas estrategias terapéuticas arrojan resultados positivos, pero al mismo tiempo advierten que se requiere mayor evidencia, mejora de los costes y la accesibilidad, reducción de las barreras tecnológicas, entrenamiento de terapeutas y cuidadores para el adecuado uso de la tecnología por la persona afectada, así como una potenciación de su uso desde asociaciones de pacientes, administraciones sanitarias, compañías informáticas y sociedades científicas17.
Robótica
En los últimos años, la robótica está teniendo una importante expansión en neurorrehabilitación. En general, este tipo de dispositivos se pueden dividir en tres grupos: robótica de servicio, non-wearables (no portátiles) de asistencia y wearables (portátiles) de asistencia.
Los dispositivos de servicio no tienen un uso terapéutico directo. Sirven de asistencia para personas con discapacidad definitiva en actividades de la vida diaria como comer, beber, vestirse, etc. Pueden estar preprogramados o ser autónomos. Utilizan una interfaz de reconocimiento de movimientos faciales, oculares, etc., o tecnología más avanzada, como interfaces cerebro-máquina con sensores de electroencefalografía integrados.
Los dispositivos de asistencia non-wearables son aquellos cuyo uso no implica la utilización de artefactos sobre la propia persona a manera de vestimenta. Tienen un uso terapéutico rehabilitador y han demostrado beneficio en estudios realizados dentro de una rutina neurorrehabilitadora en los primeros meses tras el DCS. Los robots con soporte de peso y apoyo en la marcha, como Lokomat® (Fig. 1), son un buen ejemplo.
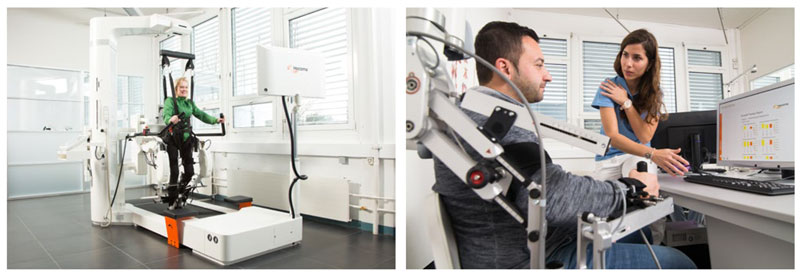
FIGURA 1. Ejemplos de robots aplicados a la neurorrehabilitación. Izquierda: Lokomat®, robot para uso terapéutico rehabilitador del miembro inferior. Derecha: Armeo®Spring, robot para uso terapéutico rehabilitador del miembro superior. Con permiso de Hocoma AG©.
Los dispositivos de asistencia wearables son aquellos que tienen que ser debidamente equipados en la persona y proporcionan un beneficio terapéutico y de ganancia de autonomía. Los exoesqueletos son el ejemplo más característico de este grupo. Tienen mayor aplicabilidad en el trabajo de funcionalidad del miembro superior (p. ej., Armeo®Spring). Al igual que los robots de servicio, pueden estar preprogramados o ser autónomos mediante el uso de interfaces18.
La evolución tecnológica de estas herramientas ya permite, al mismo tiempo que se aplica la terapia, analizar parámetros relacionados con la fuerza, la resistencia y la velocidad aplicadas por el paciente. Esta información, debidamente procesada, facilita un registro de datos al terapeuta para elaborar un plan evolutivo de la terapia aplicada, y además proporciona al propio paciente una retroalimentación (biofeedback) cuantitativa que favorece su adhesión a la terapia. Estos dispositivos permiten aumentar el número de pacientes tratados por cada terapeuta, mejorando la gestión de los recursos8.
Realidad virtual
Se trata de una tecnología en constante evolución. Permite la interacción con una réplica virtual realista para la adecuada interacción en un ambiente aplicado a la práctica de una función determinada. Cada vez existe más evidencia científica sobre sus beneficios clínicos y su capacidad de promover factores de neuroplasticidad tras el DCS, con la posibilidad de generar una retroalimentación visual, auditivita o táctil del aprendizaje motor y cognitivo por parte del paciente. Los programas diseñados para este recurso cada vez presentan mayor resolución y realismo, permitiendo enriquecer el medio virtual y favorecer el diseño del juego aplicado, algo que motivacionalmente es positivo y promueve la adecuada adhesión del paciente a los objetivos que busca el terapeuta18.
La realidad virtual es muy útil para favorecer la terapia dual, ya que permite trabajar al mismo tiempo con otras herramientas tecnológicas (soluciones híbridas), como por ejemplo la robótica o la neuromodulación transcraneal, aportando un mayor beneficio rehabilitador tanto cognitivo como motor19.
Técnicas de neuromodulación no invasiva
Las técnicas de neuromodulación no invasiva se asocian a las terapias tradicionales de rehabilitación desde etapas tempranas tras el DCS. Existen dos modalidades que van ganando evidencia de uso en este campo y que han demostrado que facilitan la regeneración neuronal a partir de los mecanismos naturales de neuroplasticidad: la estimulación magnética transcraneal repetitiva y la estimulación transcraneal por corriente directa.
Estimulación magnética transcraneal repetitiva
Genera una neuromodulación inducida por un campo magnético mediante impulsos a determinada frecuencia. La más usada habitualmente es la theta burst con tandas de 30 a 50 Hz a frecuencia theta, con dos modos de aplicación: continuo (tres estímulos cada 200 ms), para generar una inhibición en el área cortical deseada, o intermitente (2 s cada 10 s durante 190 s), para generar una estimulación18.
Estimulación transcraneal por corriente directa
Genera una neuromodulación inducida por electricidad directamente aplicada sobre el cráneo de manera continua con una intensidad de 1 a 2 mA durante 10 a 20 s. Dependiendo de la localización de los electrodos sobre el cuero cabelludo, la zona donde se coloque el ánodo genera un aumento de la excitabilidad cortical local y, en el caso del cátodo, una inhibición cortical local18.
APLICACIÓN DE LA INTELIGENCIA ARTIFICIAL EN NEURORREHABILITACIÓN
Todos estos avances en neurorrehabilitación asistida por NNTT permiten obtener una gran cantidad de datos biométricos de la función motora y cognitiva del paciente mientras se realiza la terapia y de modo evolutivo. El análisis de estos datos con herramientas de inteligencia artificial (IA) puede facilitar la automatización en el manejo terapéutico del paciente (neurorrehabilitación de precisión), algo hasta hoy reservado a las decisiones del equipo interdisciplinario responsable del paciente. También puede mejorar la eficacia de la retroalimentación y el uso de interfaces del paciente con la máquina, sea para obtener un beneficio terapéutico progresivo, sea como asistencia en aquellas discapacidades definitivas19,20.
La implementación de unidades de neurorrehabilitación con intervenciones repetitivas de larga duración, según los principios de rehabilitación por aprendizaje y neuroplasticidad21, así como el cuidado a largo plazo de la persona con DCS, implican un alto coste sanitario. Las NNTT aplicadas a la neurorrehabilitación permiten no solo evitar errores y riesgos laborales al terapeuta, sino también mejorar la eficiencia del centro, permitiendo que un mismo terapeuta pueda supervisar y dirigir la terapia de más pacientes en el mismo tiempo22. La aplicación de la IA puede facilitar mucho más este proceso.
De forma muy resumida, los algoritmos de IA siguen tres pasos: clasificación de los datos, predicción de resultados ficticios por modelos de regresión a partir de dichos datos y agrupación de estos para procesar una respuesta definitiva23. Además de los datos clínicos clásicos, la IA puede procesar datos masivos como, entre otros, los derivados de las pruebas complementarias, los generados por las tecnologías de neurorrehabilitación o asistencia, así como los cambios evolutivos en las variables biométricas de los pacientes24.
En el plano diagnóstico, su aplicación en estudios de neuroimagen y pruebas neurofisiológicas facilitaría establecer un pronóstico funcional y temporal en escenarios complejos, como por ejemplo los estados alterados de consciencia25. Además, puede ayudar a definir subtipos y perfiles clínicos concretos que optimicen las indicaciones farmacológicas y neurorrehabilitadoras de cada paciente y su efectividad26.
En el plano terapéutico, un sistema de IA conectado al dispositivo tecnológico (p. ej., un robot) podría «aprender» de los datos que se van recopilando del paciente mientras se lleva a cabo la terapia, de modo que la propia máquina sería capaz de tomar decisiones y hacer modificaciones progresivas en la terapia para el beneficio funcional o cognitivo del paciente. También posibilitaría la interconexión de los distintos recursos tecnológicos diagnósticos y terapéuticos para establecer un plan terapéutico individualizado y monitorizarlo (medicina de precisión) (Fig. 2).
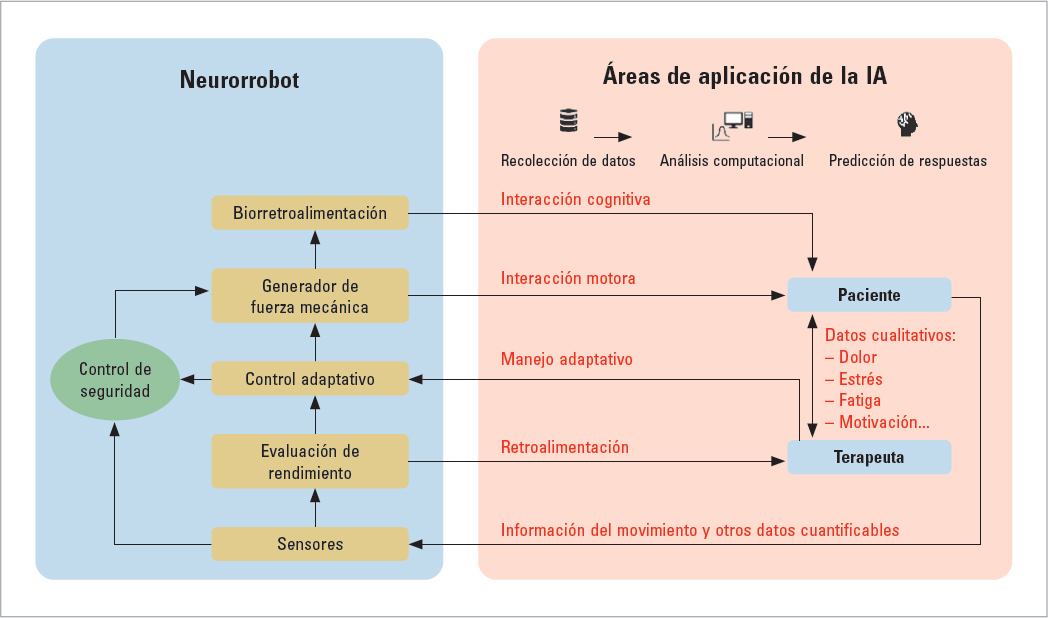
FIGURA 2. Aplicación de la inteligencia artificial en la interacción de paciente, terapeuta y neurorrobot. La inteligencia artificial brindaría apoyo al profesional neurorrehabilitador, facilitando la toma de decisiones en la aplicación progresiva de terapias dirigidas a la recuperación de funciones perdidas tras el daño cerebral sobrevenido. Del mismo modo, permite una mejora en la efectividad de la biorretroalimentación al paciente. IA: inteligencia artificial. Adaptación de Rolando et al.18
Área de aplicación motora funcional
Las NNTT de rehabilitación motora tipo robots wearables y non-wearables pueden beneficiarse de la aplicación de IA para generar un plan terapéutico progresivo, individualizado y eficaz con mínima supervisión por parte del médico rehabilitador y el terapeuta. Además, gracias a sensores específicos se podría garantizar la seguridad del paciente durante la terapia en caso de incidencias que requirieran su detenimiento urgente, e incluso identificar patrones específicos durante la terapia que anticipen y eviten accidentes.
En relación con los dispositivos de asistencia a la dependencia mediados por las interfaces antes comentadas, la IA ya está desempeñando un claro papel que, además, es clave. Piénsese, por ejemplo, que en los dispositivos controlados por una interfaz cerebro-máquina la señal de entrada, habitualmente de tipo electroencefalográfico, debe procesarse por machine learning para que el sistema aprenda que determinados patrones eléctricos cerebrales corresponden a una intención concreta —e incluso a una palabra o frase— del paciente; esto no sería posible sin IA. Además, la IA también es aplicable a estos dispositivos de asistencia en lo que concierne a su progresiva adaptación al paciente, a la adhesión por parte de este y a una mayor eficiencia de los resultados funcionales21.
Área de aplicación neurocognitiva
La afectación cognitiva tras un DCS tiene una elevada frecuencia, del 70% de los casos. Dada su complejidad, requiere una rehabilitación a más largo plazo que la rehabilitación motora. Se dispone de modelos computacionales basados en IA capaces de registrar resultados y su evolución en el tiempo en los juegos terapéuticos indicados al paciente, parametrizando dichos datos y, a partir de estos, seleccionando nuevos ejercicios, posibilitando así un entrenamiento adaptativo. Esto genera una terapia individualizada con monitorización continua que libera de tareas al terapeuta, especialmente cuando este interviene a distancia20,26,27.
DISCUSIÓN
La inclusión de las NNTT en el campo de la neurorrehabilitación tuvo ciertas resistencias iniciales, pero a partir de situaciones adversas, como la pandemia de COVID-19, los profesionales dedicados al área se vieron obligados a utilizar de manera inmediata estas herramientas, con muy buena aceptación tanto por ellos como por el paciente y su entorno.
La crítica inicial se enfocó en varias direcciones. Por un lado, se argumentó que estas NNTT carecían de flexibilidad y potencial terapéutico como para diseñar terapias cognitivas individualizadas según la situación clínica y evolutiva de cada paciente, requiriendo por tanto el seguimiento y el manejo clásico por parte del terapeuta. También se arguyó que la comunicación que estos recursos tecnológicos podían tener directamente con el paciente era limitada, de modo que el profesional debía analizar los datos obtenidos para facilitar la comprensión y la adhesión a la terapia. Por otro lado, en relación con la robótica aplicada a la rehabilitación motora, se cuestionó que no tenía capacidad de responder a hechos no predecibles, como por ejemplo que el paciente manifieste algún malestar durante la terapia, de modo que la supervisión por parte del profesional debía ser constante. Finalmente, se objetaron carencias en el uso directo de dicha tecnología para el entrenamiento en tareas de la vida cotidiana del paciente y en actividades sensoriomotoras complejas, debidas a la falta de grados de libertad y a la ausencia de una interacción eficaz del recurso con la actividad mental del paciente8. Sin embargo, han sido precisamente todos estos problemas y limitaciones los que han motivado el avance de estas tecnologías hasta su actual grado de sofisticación, siendo la IA la última en aparecer en escena para solventarlos19.
Una encuesta realizada por IQVIA en el año 2020, en la que participaron 2804 médicos de diferentes especialidades y ámbitos geográficos de España, 55 gerentes hospitalarios y 19 responsables de sistemas de información de hospitales, concluyó que todos reconocían el valor de implantar las NNTT y la IA en sus centros, la necesidad de establecer estrategias para vencer barreras e incertidumbres que limiten la innovación, y la obligación de hacer un uso correcto y seguro de los datos para optimizar el proceso asistencial con estas herramientas28.
En conclusión, corresponde a los especialistas en neurorrehabilitación reconocer el beneficio que suponen las NNTT, y en especial la IA, así como seguir fomentando su investigación y aplicación clínica, directa y temprana, tanto diagnóstica como terapéutica.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
CONFLICTO DE INTERESES
Los autores no comunican conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
Los autores declaran que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este trabajo no aparecen datos de pacientes.