Introducción
Desde la descripción clínica inicial por Sir Thomas Willis en De anima brutorum (1672)1, los síntomas del síndrome de las piernas inquietas (SPI) o enfermedad de Willis-Ekbom se han considerado fundamentalmente localizados en las piernas. Esta focalización en las piernas se vio reforzada posteriormente, cuando Lugaresi registró por primera vez durante la polisomnografía (PSG) nocturna los movimientos periódicos de las piernas (MPP)2, síntoma motor presente en el 80% de los pacientes con SPI.
La característica necesidad imperiosa de movimiento, acompañada o no de síntomas sensitivos, suele percibirse como una sensación interna, profunda, que en la mayor parte de los pacientes se localiza en las pantorrillas. Una peculiaridad del SPI que se observa a diario en la práctica clínica es la gran variabilidad en la intensidad de sus síntomas tanto de manera estacional, con frecuente empeoramiento en los meses más calurosos, como interdiaria, alternando días paucisintomáticos con otros de gran intensidad. Esta variabilidad también se observa en la localización de los síntomas, aunque esto es menos conocido y puede pasar desapercibido si la anamnesis no es minuciosa.
¿Afecta siempre a ambas piernas?
Este ha sido un punto de interés desde la descripción inicial del SPI. En la primera serie de pacientes comunicada por el propio Ekbom, cuatro de sus 48 casos presentaban síntomas estrictamente unilaterales3. Posteriormente, se han comunicado casos de SPI unilateral con MPP ipsilaterales confirmados por PSG4. En su mayor parte, estos casos son secundarios a la afectación de la vía piramidal por diversas enfermedades a lo largo del neuroeje: ictus supratentorial, hemorragia parietal, degeneración corticobasal y lesiones pontinas4.
En la definición del síndrome se utiliza el término «piernas» en plural, pero esto debe interpretarse como un concepto general, ya que, según se especifica en los criterios diagnósticos internacionales, aunque los síntomas suelen ser bilaterales, esto no siempre ocurre de manera simultánea ni simétrica. Los síntomas pueden afectar unos días a una pierna y cambiar otros a la contralateral, o incluso permanecer unilateralmente de manera crónica5. Cuando se ha evaluado sistemáticamente la localización de los síntomas del SPI antes de iniciar tratamiento, solo el 60-70% de los casos presentaba la afectación clásica, simétrica de ambas piernas. La afectación asimétrica entre ambas piernas o unilateral estricta es frecuente, variando entre el 17 y el 42%6–8 según la definición y la metodología aplicada por cada autor. Se ha postulado que esta predominancia unilateral o asimetría puede aparecer en las fases iniciales, dando paso a una afectación más simétrica con la evolución de la enfermedad9, aunque no se dispone de estudios prospectivos a largo plazo que confirmen esta hipótesis.
La afectación unilateral es más frecuente en el SPI de inicio tardío, por encima de los 45 años; estos casos presentan antecedentes familiares de SPI con menor frecuencia que los casos clásicos. Esto se debe a que, con frecuencia, estos casos son secundarios a otras causas (diabetes mellitus, ictus, radiculopatía, polineuropatía, mielopatía, etc.)10. La prevalencia de SPI secundario a ictus varía en las distintas series entre el 7,7 y el 12%. Las lesiones isquémicas causantes se han localizado tanto a nivel cortical como subcortical (ganglios basales, tálamo, corona radiada, cápsula interna, troncoencéfalo, etc.)11.
¿Qué mecanismos subyacen en la presentación unilateral o asimétrica?
En la fisiopatología del SPI se ha constatado la presencia de una alteración en el metabolismo del hierro a nivel sistémico y central, así como disfunción de los sistemas dopaminérgico, glutamatérgico, adenosinérgico, opioide y orexinérgico. Aunque los hallazgos más característicos se localizan en la sustancia negra, muchas otras estructuran participan en la génesis de los síntomas, incluyendo la corteza motora y sensitiva, el estriado, el giro cingulado anterior, el tálamo, la región hipotalámica A11, el núcleo rojo, el cerebelo y la oliva inferior12.
La fisiopatología subyacente a los casos unilaterales parece ser similar a los casos clásicos, bilaterales y simétricos. Para explicar la unilateralidad se han postulado diversas hipótesis:
- – La lesión de la vía piramidal provocaría la pérdida del control inhibitorio espinal sobre las proyecciones hipotalámicas dopaminérgicas que se inician en la región A1113.
- – La disfunción del circuito dopaminérgico estriatal-troncoencefálico y sus proyecciones medulares podría alterar el control motor, llevando a una pérdida del mecanismo inhibitorio con el consecuente reclutamiento patológico de los reflejos espinales o propioespinales10.
- – La desinhibición de estos reflejos espinales y la sensibilización central secundaria podría activarse también como consecuencia de una disfunción periférica en la modulación sensorial. En los casos de SPI asociados a polineuropatía, la afectación de fibras finas (tipo C y A delta) contribuiría así al desarrollo de los síntomas14.
- – Las anomalías del metabolismo del hierro y la dopamina ocurrirían de una manera más focal, respetando un hemicuerpo. Los casos secundarios a ictus lacunares subcorticales o compresión radicular serían un ejemplo de esta afectación focal.
¿Pueden los síntomas aparecer en localizaciones diferentes a las piernas?
Pese a denominarse síndrome de las «piernas inquietas», los síntomas pueden afectar a otras regiones corporales. Cuando esto ocurre como consecuencia del empeoramiento del SPI secundario al fenómeno de aumento, uno de cuyos criterios diagnósticos es la progresión proximal de los síntomas afectando con frecuencia a los brazos, no podría considerarse una forma atípica del SPI.
Se habla de variantes del SPI cuando los síntomas se localizan exclusivamente en localizaciones atípicas, sin afectación de las piernas3. En este sentido, la denominación enfermedad de Willis Ekbom podría ser más apropiada e inclusiva, permitiendo ampliar nuestras miras atendiendo a la descripción de los síntomas por parte de los pacientes, dando así valor a aquellos síntomas que aparecen en localizaciones diferentes a las piernas.
Se han comunicado variantes de SPI en múltiples localizaciones (Fig. 1). En estos casos, los pacientes refieren la misma necesidad imperiosa de movimiento o malestar en las regiones afectadas, y al igual que sucede en el SPI, con frecuencia tienen dificultad para verbalizar los síntomas. A veces los describen como una sensación de picor, hormigueo, espasmos, calambres y dolor. La necesidad de movimiento se manifiesta en función de la localización como una necesidad de frotar la espalda contra el colchón, frotarse la región afectada, mover la lengua, mascar chicle, agitar los brazos o incluso orinar.
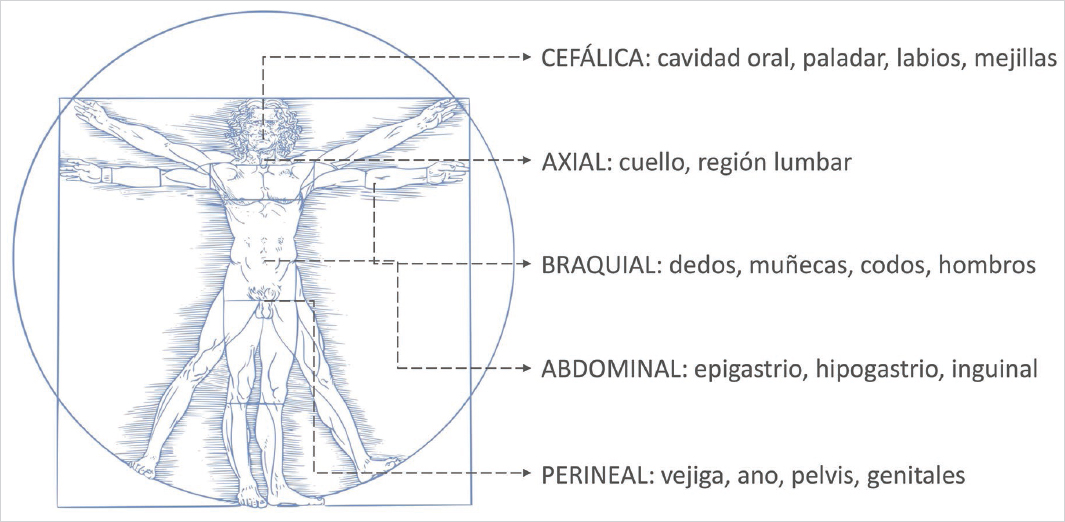
Figura 1. Localización de las variantes del síndrome las piernas inquietas según la literatura15.
Una de las localizaciones más frecuente de las variantes del SPI es la cara, donde suele afectar principalmente a la cavidad oral. La necesidad de movimiento se focaliza en los labios/lengua, realizando gesticulaciones y/o movimientos linguales para lograr alivio.
Se ha comunicado una posible relación del SPI con el síndrome de la boca ardiente (SBA). Este síndrome cursa con disestesias orales dolorosas que con frecuencia asocian dolor en localizaciones extraorales. El SBA y el SPI comparten el origen idiopático de ambos, un claro predominio femenino, su inicio en edades medias o avanzadas de la vida, la presencia de un patrón circadiano con empeoramiento vespertino/nocturno y la afectación secundaria del sueño. Los pacientes con SBA tienden a realizar movimientos repetitivos linguales para aliviar los síntomas, pudiendo asociar una necesidad imperiosa de mover la lengua que recuerda al SPI. Se ha propuesto que algunos de estos casos, aquellos en que se constata la necesidad imperiosa de movimiento, pueden constituir una variante del SPI. Es más, algunos de estos casos han respondido al tratamiento dopaminérgico16. De hecho, en el 20-40% de los pacientes con SBA se observa disfunción dopaminérgica central, lo que reafirma su posible relación fisiopatológica con el SPI17. Sin embargo, otros casos de SBA responden a bloqueantes dopaminérgicos, por lo que dentro de este síndrome probablemente se incluyen diferentes perfiles clínicos con diferentes sustratos fisiopatológicos. Una anamnesis detallada puede identificar aquellos casos que realmente constituyen una variante del SPI.
Otra localización frecuente de las variantes del SPI es el abdomen. Cabe destacar que la descripción de los primeros tres casos de «abdomen inquieto» la realizó el grupo de investigación del Hospital Clínic Barcelona. Todos ellos cumplían los criterios diagnósticos internacionales de SPI, asociaban MPP durante el sueño con confirmación PSG y mejoraron con pramipexol18.
La pelvis y/o los genitales también son localizaciones frecuentes. En estos casos, los síntomas se manifiestan como malestar, incomodidad o disestesias genitales que pueden asociar dolor (vulvodinia y penoscrotodinia)19. Estos casos se clasificaban previamente como «síndrome de alerta sexual persistente» (persistent sexual arousal syndrome en terminología anglosajona). En aquellos casos en que se observa un empeoramiento en reposo, ritmo circadiano con predominio vespertino/nocturno de los síntomas y mejoría con el movimiento se plantea su relación con el espectro del SPI, habiéndose acuñado el término «síndrome de los genitales inquietos» (restless genital syndrome). La necesidad de movimiento se manifiesta mediante manipulaciones de los genitales, o conductas sexuales o masturbatorias tanto durante la vigilia como en los despertares/alertamientos del sueño NREM (no REM [rapid eye movement]).
Además de en las diferentes regiones previamente mencionadas, se han publicados varios casos de SPI en miembros fantasma. No se trata de casos con SPI previa, sino que el SPI debutó tras la amputación de la extremidad20–22, por lo que podría hablarse de «SPI fantasma».
En las diferentes series publicadas, la edad media de los pacientes con estas variantes del SPI fue menor que en el SPI clásico9,15,23. Mientras que el SPI muestra un claro predominio femenino, con prevalencias 2-3 veces mayores en mujeres, en las variantes de SPI no se observan claras diferencias de género12.
¿Cómo se diagnostican estas variantes y formas atípicas?
Para alcanzar el diagnóstico de variante del SPI, durante la anamnesis dirigida debe comprobarse que se cumplen los cuatro criterios principales (Tabla 1)5 y excluirse diagnósticos alternativos, ampliando el estudio etiológico con las pruebas complementarias necesarias. Debido a la localización atípica de los síntomas, el retraso diagnóstico es mayor que en el SPI clásico: hasta 34 años en algunos casos. Dada la clínica atípica, el diagnóstico de variante del SPI puede reforzarse mediante la confirmación de la presencia de criterios de apoyo al diagnóstico de SPI como:
Tabla 1. Criterios diagnósticos del síndrome de las piernas inquietas: International Restless Legs Syndrome Study Group (IRLSSG)5
| Urgencia para mover las piernas, normalmente, aunque no siempre acompañada o causada por sensaciones desagradables y molestias en las piernas |
| Los síntomas comienzan o empeoran durante periodos de reposo o inactividad, como estar acostado o sentado |
| Los síntomas se alivian parcial o totalmente por el movimiento, al menos durante su duración (o esto se constató en el inicio de la enfermedad si esta tiene un curso crónico) |
| Los síntomas ocurren únicamente o empeoran en la tarde/noche (o esto se constató en el inicio de la enfermedad si esta tiene un curso crónico) |
| Las características anteriores no representan síntomas primarios o únicos de otros trastornos médicos o conductuales (p. ej., mialgias, estasis venosa, edema de los miembros inferiores, artritis, calambres en las piernas, malestar posicional, zapateado habitual) |
Especificador de curso clínico:
|
| Especificador de significación clínica: repercusión sociolaboral, sobre el sueño, el ánimo o la calidad de vida |
|
SPI: síndrome de piernas inquietas. |
- – Antecedentes familiares de SPI: el 26,4% de los pacientes con variantes de SPI comunicados en la literatura tenía antecedentes familiares de SPI, lo que se asemeja al componente familiar reportado por pacientes con SPI clásico. Esto sugiere que los mismos SNP (single nucleotide polymorphism) aumentan el riesgo de síntomas tanto en las piernas como en otras regiones corporales.
- – Presencia de MPP en la PSG: en más del 50% de los casos de variantes del SPI estudiados mediante PSG se registraron MPP en grado moderado. Esta proporción es significativamente inferior al 80% de pacientes con SPI clásico que asocia MPP15. El hecho de que sin tener síntomas en las piernas se presenten los característicos MPP apoya la hipótesis de que la fisiopatología subyacente en las variantes del SPI es similar a la del SPI clásico, pero con disociación en la localización de los síntomas sensitivos y motores.
Además de los MPP, se pueden observar otros movimientos repetitivos durante el sueño como: movimientos rítmicos del tronco o pelvis, sacudidas o estiramientos de los brazos, movimientos cíclicos abdominales, rocking abdominal, así como masturbación o actividad sexual durante los despertares/alertamientos en sueño NREM, entre otros15.
Para aliviar los síntomas, los pacientes no siempre necesitan mover la región corporal afectada, pues en ocasiones refieren mejoría al caminar, lo que refuerza la relación de estos síntomas con el SPI clásico.
- – Respuesta a tratamiento dopaminérgico: buena en la mayoría de las series publicadas. Esto apoya la presencia de una disfunción central dopaminérgica del circuito somatosensorial similar al SPI clásico. En la práctica clínica se puede pautar un agonista dopaminérgico a dosis baja durante 7-14 días como test diagnóstico. Aunque la respuesta sea favorable, no se debe mantener a largo plazo por el alto riesgo de fenómeno de aumento, debiéndose cambiar a un tratamiento de los que actualmente se consideran de primera elección (ligandos αδ como gabapentina y pregabalina).
Algunos autores han comunicado ensayos terapéuticos con fármacos no dopaminérgicos como clonazepam, gabapentina u opioides, pero la respuesta a estos es menos específica y no se puede utilizar para confirmar la relación con el espectro clínico del SPI. También se ha comunicado respuesta al tratamiento con hierro oral o intravenoso15.
- – Repercusión clínica. En las variantes del SPI parece similar al SPI clásico. En tres cuartas partes de los casos los síntomas interfieren con la conciliación del sueño.
¿Pueden progresar los síntomas a otras regiones corporales?
En efecto, está bien documentado que los síntomas pueden iniciarse en las piernas, como un SPI clásico, y con el tiempo progresar proximalmente afectando a otras regiones, sin relación con el tratamiento dopaminérgico o el fenómeno de aumento, como parte de la propia evolución de la enfermedad15.
En un análisis sistemático de los casos publicados con este curso crónico ascendente, la progresión proximal de los síntomas ocurrió tras un periodo variable de 0-9 años10. El 63,4% de los pacientes presentaba síntomas en periné/genitales en forma de «genitales inquietos», hipersensibilidad uretral o vejiga hiperactiva; en el 19,5% los síntomas alcanzaron el tronco; en el 12,19% llegaron a la cabeza/cuello; y en el 4,8% afectaron a todo el cuerpo, pudiéndose confundir con una acatisia. A diferencia de las variantes del SPI, en estos casos los pacientes presentarán también los síntomas clásicos en las piernas.
Conclusiones
El espectro del SPI es más amplio que la clásica afectación bilateral simétrica de las piernas. El SPI puede ser unilateral, alternar entre ambas piernas o seguir un curso ascendente sin relación con el fenómeno de aumento. Los síntomas pueden afectar a cualquier región corporal, pero son más frecuentes en cara, abdomen y genitales. El diagnóstico es clínico, con base en los criterios internacionales. Las maniobras para aliviar los síntomas pueden ser simples o abigarradas (movimientos pélvicos repetitivos, manipulación genital, etc.).
La fisiopatología de estos casos atípicos es similar al SPI clásico, aunque con cierta frecuencia pueden ser secundarios a una afectación de la vía piramidal y en ocasiones periférica. En consecuencia, es necesario ampliar el estudio etiológico para descartar un origen secundario a lesiones del neuroeje.
Su repercusión clínica es similar al SPI clásico. El manejo terapéutico debe seguir las recomendaciones actuales, aunque se puede utilizar una pauta corta con agonistas dopaminérgicos como prueba de confirmación diagnóstica.
Financiación
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
Conflicto de intereses
La autora no comunica conflicto de intereses en relación con el contenido del trabajo.
Consideraciones éticas
Protección de personas y animales. La autora declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. La autora declara que no utilizó ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.