Introducción
En condiciones normales, el cambio desde el decúbito a la bipedestación conlleva una caída momentánea de la presión arterial (PA) como consecuencia del desplazamiento del contenido vascular a las zonas declives. Por ello, en sujetos sanos, la respuesta normal con el cambio de posición mantiene la PA y el flujo vascular cerebral. En este sentido, una caída de 20 mmHg en la PA sistólica (PAS) o de 10 mmHg en la PA diastólica (PAD) a los 3 minutos del cambio de posición (desde el decúbito o en el test de la mesa basculante [tilt test] a 60º), se considera patológica y se define como hipotensión ortostática (HO)1. En pacientes con antecedentes de hipertensión arterial o con parkinsonismo, se exige una caída de al menos 30 mmHg en la PAS y de 15 mmHg en la PAD1.
La HO es frecuente en la población y su prevalencia aumenta con la edad, especialmente en ancianos frágiles. Afecta aproximadamente a uno de cada cinco adultos mayores de 60 años y hasta una cuarta parte de los pacientes que presentan síncopes de etiología indeterminada e intolerancia ortostática tienen HO2. La HO puede reducir la perfusión de los órganos situados por encima del corazón, especialmente el cerebro, lo que conlleva síntomas de hipoperfusión tisular. Estos síntomas pueden provocar caídas traumáticas, aumentar el riesgo de diferentes afecciones, y en última instancia, tener un profundo impacto en la calidad de vida, incrementando la morbilidad y mortalidad de las personas que la padecen3.
La HO puede ser consecuencia de diversas afecciones médicas como el desacondicionamiento físico, la depleción de volumen intravascular, la insuficiencia venosa crónica o el uso de diferentes tratamientos farmacológicos. En estos casos, se denomina HO no neurogénica y suele mejorar tras el tratamiento de la causa subyacente. En una minoría de pacientes, es consecuencia de una liberación reducida de noradrenalina (NA) de los nervios simpáticos posganglionares, lo que conduce a un defecto de la vasoconstricción por fallo barorreflejo, que se denomina HO neurogénica (HOn)4,5 (Fig. 1). La HOn tiene lugar en aproximadamente un tercio de los pacientes con HO y es frecuente en pacientes con trastornos neurodegenerativos debidos a la acumulación de alfa-sinucleína (sinucleinopatías), como la enfermedad de Parkinson (EP), la demencia con cuerpos de Lewy, la atrofia multisistémica (AMS) y la insuficiencia autonómica pura (IAP)4,5. La HOn también puede aparecer tras lesiones medulares, polineuropatías de fibra fina y en enfermedades disinmunes o paraneoplásicas.
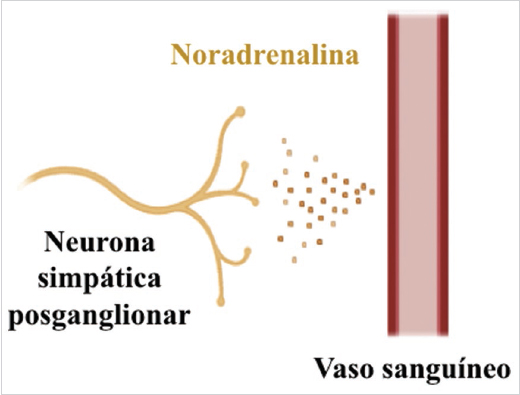
Figura 1. Neurotransmisión noradrenérgica en la hipotensión ortostática neurogénica. En la hipotensión ortostática neurogénica (p. ej., en la enfermedad de Parkinson), se produce una reducción en la liberación de noradrenalina en los nervios simpáticos posganglionares, lo que resulta en una vasoconstricción defectuosa por fallo barorreflejo. El déficit de noradrenalina puede ser tratado mediante la administración oral del precursor de noradrenalina o con agonistas adrenérgicos como la midodrina (figura creada con Biorender.com; adaptada de Palma et al., 20175).
La HO puede ser sintomática o asintomática, de forma que los síntomas variarán en función de diferentes factores como la magnitud de la caída en la PA, el momento del día, las condiciones ambientales o el estado general y muscular del sujeto. Es por ello que algunos pacientes con HO crónica toleran PA muy bajas sin llegar a referir sintomatología o solo síntomas leves; sin embargo, la aparición de un síncope puede ocurrir con factores estresantes ortostáticos adicionales (p. ej., comidas abundantes ricas en carbohidratos, vasodilatadores, deshidratación, etc). Los síntomas más frecuentes de la HO son mareo, vértigo, astenia, visión borrosa, torpeza mental, sensación de vahído y finalmente, síncope. Algunos pacientes pueden referir cefalea, dolor cervical e incluso disnea. En general, los síntomas se presentan al adoptar el ortostatismo y se alivian con el decúbito, aunque en ocasiones pueden aparecer con la sedestación. En la práctica clínica es relevante distinguir entre la HOn y la no neurogénica, para orientar adecuadamente el diagnóstico y tratamiento. A continuación, se resumen las diferentes estrategias manejo y de tratamiento de esta entidad, así como algunos consejos prácticos, que nos permitirán mejorar la calidad de vida de los pacientes con HO.
Diagnóstico de la hipotensión ortostática neurogénica
Para el estudio de la HOn es necesaria la realización de una historia clínica y una exploración neurológica completa. Los síntomas de la HOn pueden ser inespecíficos, como fatiga y dificultad para concentrarse, e incluso pueden manifestarse de forma similar a las fluctuaciones motoras off en pacientes con sinucleinopatías5. En general, los síntomas de activación autonómica que preceden al síncope como diaforesis, taquicardia y náuseas están ausentes en estos pacientes, recuperándose rápidamente tras el episodio. Los síntomas de HO suelen fluctuar lo largo del día, agravándose en las primeras horas de la mañana debido a la pérdida de volumen intravascular durante la noche. El sedentarismo es frecuente en pacientes con HOn, lo que propicia un desacondicionamiento cardiovascular y puede empeorar la caída de la PA y, por tanto, la sintomatología. A su vez, pueden asociar síntomas de disfunción autonómica como trastornos de la sudoración, digestivos o urinarios. Finalmente, para evaluar de manera integral la gravedad de los síntomas de la HOn, su impacto funcional y la eficacia del tratamiento se dispone de una escala validada: el Orthostatic Hypotension Questionnaire (OHQ)6.
El diagnóstico de HO debe basarse en dos o más mediciones en diferentes días, siendo la medición por la mañana más sensible para detectar la HO7,8. Como se ha comentado con anterioridad, para el diagnóstico es necesaria la medición de la PA en decúbito supino y en posición vertical, tras adoptar el ortostatismo o mediante el test de la mesa basculante-tilt test, para determinar la presencia de una caída ortostática sostenida de al menos 20 mmHg de PAS o 10 mmHg de PAD1. Para ello, el paciente debe permanecer en decúbito supino durante varios minutos y después en bipedestación (o inclinado pasivamente) durante 1 a 3 minutos. El cambio en la frecuencia cardíaca (FC) con el ortostatismo ayuda a determinar si la HO es de origen neurogénico. En aquellos pacientes con HOn, la inervación simpática anómala hace que la FC se incremente menos de lo esperado al reducirse la PA con el cambio de posición; en cambio, los incrementos marcados en la FC sugieren un origen no neurogénico9 (Tabla 1). Para la valoración de la HO temprana se recomienda la medición mediante un aparato automático en cortos intervalos de tiempo o tras el ortostatismo activo (no con el test de la mesa basculante-tilt test). Por el contrario, para la evaluación de la HO tardía es aconsejable el test de la mesa basculante, ya que el sujeto ha de estar en bipedestación un tiempo prolongado. Se debe adecuar este tiempo a la edad del paciente, ya que los sujetos jóvenes tienen con más frecuencia HO tardía10.
Tabla 1. Datos diferenciales de la hipotensión ortostática neurogénica y no neurogénica
| HO no neurogénica | HO neurogénica | |
|---|---|---|
| Prevalencia | Frecuente | Infrecuente |
| Etiología | Pérdida de volumen intravascular (p. ej., anemia) Acumulación de sangre (p. ej., insuficiencia venosa) Desacondicionamiento físico Fármacos antihipertensivos |
Liberación anómala de noradrenalina con el ortostatismo |
| Pronóstico | Se resuelve con el tratamiento de la causa subyacente | Crónico |
| Función autonómica Tono simpático Noradrenalina plasmática Respuesta de la FC con el ortostatismo Respuesta de la PA con la maniobra de Valsalva (fase IV) |
↑ Normal o ↑ (al menos x 2) ↑↑ Presente |
↓ o ausente ↓ o ausente Mínima o ausente Ausente |
| Síntomas autonómicos | Ausentes | Presentes (p. ej., estreñimiento, trastornos esfinterianos, alteraciones en la sudoración, etc.) |
| Síntomas o signos neurológicos | Ausentes (o no relacionados con la HO) | Parkinsonismo Signos cerebelosos Deterioro cognitivo Neuropatía sensitiva |
|
FC: freciencia cardíaca; HO: hipotensión ortostática; PA: presión arterial. Adaptada de Palma et al., 20175. |
||
Adicionalmente, para el diagnóstico de HOn, puede ser útil la realización de diferentes pruebas de función autonómica, como la medición de los niveles de NA plasmática. Teniendo en cuenta su origen simpaticoneural, los niveles plasmáticos de NA pueden utilizarse para indicar la actividad del sistema noradrenérgico simpático11. Un aumento de la NA plasmática de menos del 100% después de 5 a 10 minutos tras el ortostatismo sugiere una activación simpática defectuosa y, por tanto, un origen neurogénico de la HO5 (Tabla 1). Otra prueba de función autonómica es la evaluación de la respuesta de la PA tras la maniobra de Valsalva, que proporciona información sobre la función vasoconstrictora simpática periférica y simpática cardíaca; en los pacientes con HOn, la fase II tardía y la fase IV (fases de recuperación) pueden estar ausentes debido a una disfunción del reflejo barorreceptor. Finalmente, en la monitorización ambulatoria de la PA (MAPA) puede detectarse una inversión del patrón circadiano de la PA, con valores más elevados durante la noche que durante el día (patrón dipper invertido)12.
Manejo de la hipotensión ortostática neurogénica
No existen pautas de consenso para el tratamiento de la HOn y los estudios que evalúan el impacto de las diferentes medidas terapéuticas en la calidad de vida, morbilidad y mortalidad son limitados. El tratamiento debe tener como objetivo principal reducir la incidencia y gravedad de la sintomatología, y permitir que el paciente pueda estar de pie durante periodos de tiempo más prolongados para poder realizar sus actividades de forma independiente, no restablecer la normotensión. Los pasos del tratamiento incluyen: 1) corregir los factores desencadenantes y agravantes; 2) implementar medidas no farmacológicas, y 3) terapias farmacológicas5,13 (Fig. 2).
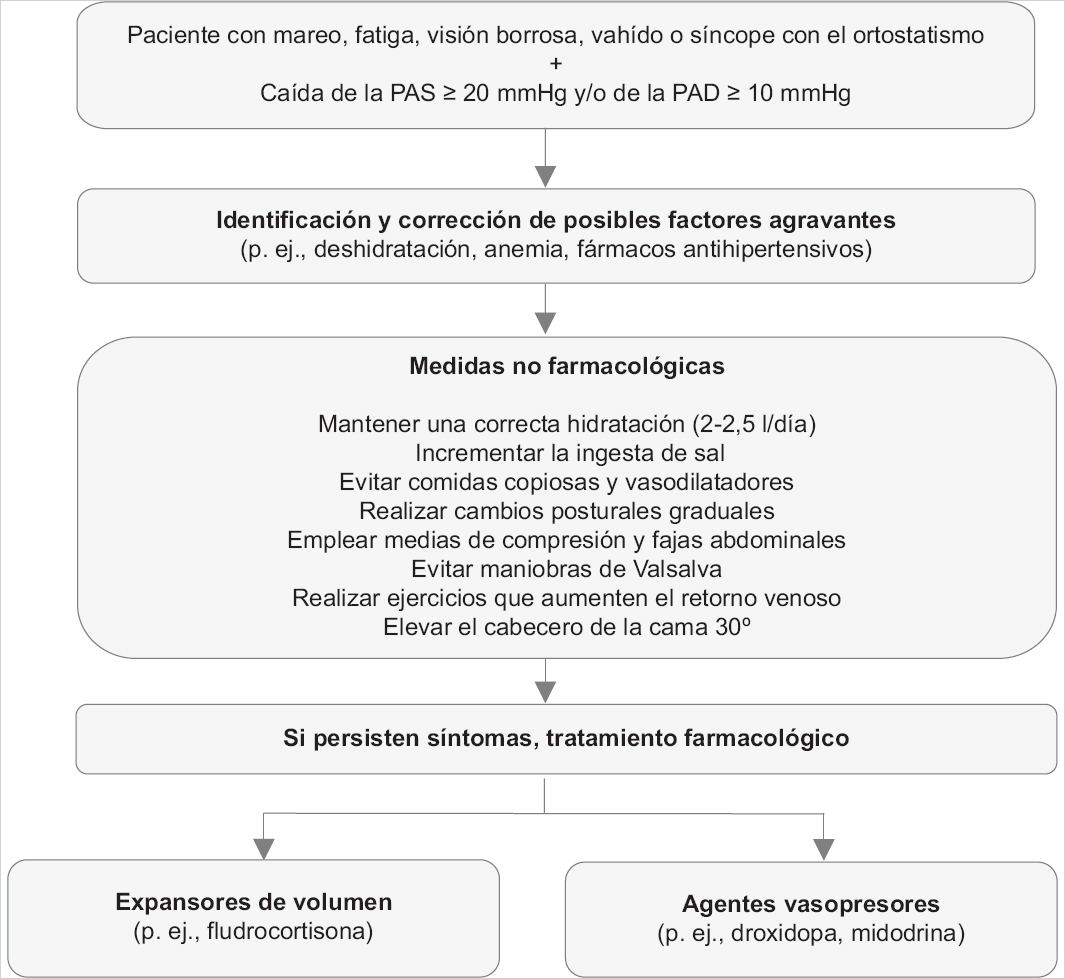
Figura 2. Algoritmo de tratamiento de la hipotensión ortostática neurogénica. PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Identificación y corrección de factores desencadenantes y agravantes
El primer paso tras el diagnóstico es la explicación comprensible del proceso al paciente y la identificación de los posibles factores desencadenantes, por ello es importante que el paciente conozca el impacto de sus hábitos de vida en la HO (Tabla 2). Como se ha comentado anteriormente, es necesario corregir posibles factores agravantes de la HO como la deshidratación, la anemia o los déficits vitamínicos.
Tabla 2. Medidas no farmacológicas para el manejo de la hipotensión ortostática neurogénica
| Medida | Mecanismo de acción | Recomendación |
|---|---|---|
| Evitar comidas copiosas y abundantes en carbohidratos | ↓ la vasodilatación esplácnica | Ingerir cantidades pequeñas y frecuentes de comida |
| Realizar actividad física | ↑ la masa muscular | Realizar ejercicio en posición reclinada o sedestación (p. ej., bicicleta fija o máquina de remo) Evitar el reposo prolongado |
| Mantener una buena hidratación e ingesta de sal | ↑ el volumen intravascular ↓ la producción de óxido nítrico |
Ingerir 2-2,5 l/día de agua y 10-20 g de sal/día |
| Realizar maniobras de contrapresión | ↑ la PA y el gasto cardíaco | Cruzar las piernas, inclinarse hacia adelante, ponerse en «cuclillas» |
| Utilizar prendas de compresión | ↑ la PA | Compresión abdominal (20-30 mmHg) y hasta muslo (30-40 mmHg) |
| Elevar la cabecera de la cama | ↓ la diuresis nocturna | Elevar la cabecera de la cama 30º (p. ej., cama articulada o reclinable) |
|
PA: presión arterial. Adaptada de López-Bravo, 202113. |
||
ENFERMEDADES CONCOMITANTES Y FÁRMACOS ANTIHIPERTENSIVOS
Una vez diagnosticada la HO se ha de tener en cuenta la presencia de comorbilidades, como las que provocan hipovolemia y otras causas subyacentes que puedan influir en la sintomatología14. Es imprescindible evaluar la medicación, dado que los tratamientos farmacológicos que provocan vasodilatación o actúan en el sistema nervioso simpático (bloqueando la liberación o actividad de la NA) pueden causar, o contribuir a la HO. Pese a ello, si un paciente hipertenso en tratamiento presenta HO no debe interrumpirse la toma de la medicación habitual. La HO se relaciona frecuentemente con el uso de diuréticos, alfabloqueantes, betabloqueantes, antagonistas del calcio no dihidropiridínicos, inhibidores de la fosfodiesterasa-5, nitratos y alfa-agonistas de acción central15. Los antidepresivos tricíclicos y antipsicóticos también pueden ocasionar HO. Finalmente, los agonistas dopaminérgicos y la levodopa pueden reducir la PA, y en ese caso, se puede considerar un ajuste de dosis.
Medidas no farmacológicas
ESTILO DE VIDA Y ACTIVIDAD FÍSICA
En el manejo de la HOn es fundamental aconsejar al paciente sobre el estilo de vida y la actividad física. Se debe explicar detalladamente el efecto de los cambios gravitacionales sobre la PA y los síntomas ortostáticos, recomendando cambios de posición graduales y realizar ejercicios con las extremidades inferiores antes de adoptar la bipedestación. Asimismo, las maniobras de Valsalva pueden producir una caída grave y sostenida de la PA, por lo que deben evitarse esfuerzos que puedan desencadenar esta caída y un posible síncope. Las maniobras y ejercicios que incrementen el retorno venoso (p. ej., cruzar las piernas, ponerse de puntillas y contraer los glúteos) elevan la PA y reducen los síntomas ortostáticos, por lo que son recomendables16.
Los ambientes cálidos y húmedos, las duchas calientes o el uso recreativo de saunas pueden exacerbar los síntomas de HO, por lo que se deben evitar. El sedentarismo conlleva la pérdida de músculo esquelético y un desacondicionamiento físico, lo que puede agravar los síntomas de HO. Por ello, se debe recomendar la realización de actividad física habitual, preferiblemente en posición reclinada o sedestación (p. ej., bicicleta fija o máquina de remo). En este sentido, el ejercicio en piscina es especialmente beneficioso, al contrarrestarse la caída en la PA y mejorar la tolerancia ortostática.
ALIMENTACIÓN Y MEDIDAS DIETÉTICAS
Los posibles desencadenantes alimentarios también deben tenerse en cuenta, ya que la vasoconstricción que se produce de forma habitual tras la ingesta de alimentos es insuficiente en los pacientes con HOn, pudiendo presentar hipotensión posprandial grave, especialmente tras el consumo de carbohidratos y comidas copiosas17. Se recomienda evitar vasodilatadores como el alcohol o la cafeína y mantener una buena hidratación, con una ingesta de agua de 2 a 2,5 l/día. En algunos casos puede ser necesario incrementar la ingesta de sal, agregando una o dos cucharaditas a una dieta saludable.
MEDIAS DE COMPRESIÓN Y FAJAS ABDOMINALES
Las medias de compresión ejercen contrapresión en las extremidades inferiores y abdomen, lo que reduce la filtración de los capilares y la acumulación de líquido las venas, mejorando el retorno venoso. Es por tanto recomendable el uso de medias de cintura alta (compresión de al menos 15 a 20 mmHg)18. De la misma forma, la compresión abdominal moderada mediante fajas elásticas (compresión venosa sostenida de aproximadamente 40 mmHg) antes del cambio postural puede aminorar la caída de la PA, llegando a ser tan efectiva como el tratamiento farmacológico19.
CUIDADOS DURANTE EL SUEÑO
La hipertensión arterial se asocia con la HO, especialmente en decúbito supino, por lo que es necesario realizar un control estricto de la PA. Para evitar su aparición, se recomienda evitar la posición supina durante el día, siendo aconsejable el descanso en una silla reclinable. Se deben evitar los fármacos vasopresores antes del descanso nocturno, de manera que la última dosis se administre unas horas antes de acostarse. Durante la noche, es recomendable elevar la cabecera de la cama para lograr un ángulo aproximado de 30º (p. ej., cama articulada o reclinable)5,20. En una minoría de pacientes puede ser necesario el uso de fármacos antihipertensivos si persiste la hipertensión arterial supina grave tras implementar las medidas no farmacológicas. En ese caso, se debe informar sobre el riesgo de hipotensión y caídas al levantarse durante la noche.
Tratamiento farmacológico
Pese a que el manejo inicial se basa en proporcionar consejos sobre el estilo de vida y el uso de medidas no farmacológicas, algunos pacientes van a requerir terapias farmacológicas. En general, estas terapias se basan en la expansión de volumen intravascular mediante el uso de mineralocorticoides y/o en aumentar la resistencia vascular periférica con agentes vasopresores. Los fármacos más utilizados son: fludrocortisona, midodrina, droxidopa y piridostigmina21 (Tabla 3). La selección de uno, otro o su combinación depende de las características y necesidades específicas de cada paciente, siendo aconsejable la terapia combinada si el tratamiento en monoterapia no es efectivo. Tras el inicio del tratamiento farmacológico es importante alertar a los pacientes de que todos los fármacos que aumentan la PA durante la bipedestación lo hacen en posición supina, lo que incrementa la posibilidad de agravar la intolerancia ortostática.
Tabla 3. Tratamientos farmacológicos utilizados en la hipotensión ortostática neurogénica
| Tratamiento | Fludocortisona | Midodrina | Droxidopa | Piridostigmina |
|---|---|---|---|---|
| Mecanismo de acción | Mineralocorticoide | Agonista selectivo de los receptores alfa-1-adrenérgicos | Precursor de norepinefrina | Inhibidor de acetilcolinesterasa |
| ↑ PA al aumentar el volumen intravascular | ↑ PA al aumentar la resistencia vascular | ↑ PA al inducir vasoconstricción | ↑ la transmisión colinérgica ganglionar | |
| Posología | 0,1-0,2 mg/24 h | Inicio con 2,5 mg e incremento progresivo hasta 30 mg/24 h | 100-600 mg/24 h | 30-60 mg/24 h |
| Última dosis más de 4 h antes de acostarse | Titulación lenta e incrementos progresivos Última dosis más de 3 h antes de acostarse | 1-3 tomas/día | ||
| Última dosis más de 3 h antes de acostarse | ||||
| Reacciones adversas | Nefrotoxicidad Hipopotasemia Descompensación cardíaca | HTA supina Piloerección Prurito | HTA supina Cefalea Mareo Náuseas | Síntomas gastrointestinales y urinarios ↑ de la salivación y sudoración |
|
HTA: hipertensión arterial; PA: presión arterial. Adaptado de Isaacson SH, et al., 202121. |
||||
FLUDROCORTISONA
La fludrocortisona (también conocida como 9-alfa-fluorocortisol) es un corticosteroide sintético con moderada acción glucocorticoide y mayor potencia mineralcorticoide. Promueve la absorción renal de agua y sodio e incrementa la excreción renal de potasio y protones, expandiendo así el volumen intravascular y aumentando la PA en posición supina, sedestación y bipedestación. Se emplea habitualmente como tratamiento sustitutivo mineralocorticoide en insuficiencias suprarrenales primarias o secundarias, como la enfermedad de Addison y la hiperplasia suprarrenal congénita22.
Pese a que no dispone de la autorización con esta indicación por parte de la European Medicines Agency (EMA), la fludrocortisona suele emplearse en el tratamiento de la HO. Los resultados terapéuticos requieren aproximadamente 1-2 semanas de tratamiento y la dosis no debe exceder los 0,1-0,2 mg diarios. Debido a su mecanismo de acción, debe utilizarse con precaución, dado que puede tener efecto nefrotóxico u otros efectos adversos como edema e hipopotasemia, por lo que se aconseja el consumo de alimentos ricos en potasio o suplementos de potasio (p. ej., cloruro de potasio 20 mEq diarios)23. Además, su uso a largo plazo puede causar hipertensión arterial supina, hipertensión arterial supina e hipertrofia ventricular5,24.
MIDODRINA
La midodrina es un profármaco oral que se convierte periféricamente en el metabolito activo desglimidodrina, agente simpaticomimético con efecto directo y selectivo sobre los receptores alfa-1-adrenérgicos, y que, por tanto, induce vasoconstricción del sistema venoso. Recibió la autorización de la Food and Drug Administration (FDA) en 1996 para el tratamiento de la HO sintomática, basándose en ensayos clínicos aleatorizados, doble ciego, controlados con placebo, que incluyeron a pacientes con HOn de diferentes etiologías25–27. En España está comercializada desde el año 2002 para el tratamiento de HO grave debida a disfunciones del sistema nervioso autónomo, cuando las medidas correctoras no han sido eficaces y otras formas de tratamiento son inadecuadas28. Su administración incrementa la PAS y la PAD en pacientes con HOn en decúbito supino, sedestación y bipedestación, aproximadamente una hora después de su ingesta.
Es necesario iniciar el tratamiento con dosis de 2,5-5 mg, que pueden incrementarse hasta 10 mg tres veces al día como dosis de mantenimiento, en función de los registros de PA. No se aconseja superar esta dosis y se debe adaptar individualmente dependiendo de las particularidades del paciente. La última dosis del día se debe administrar al menos 4 horas antes de acostarse para prevenir la hipertensión arterial supina, siendo recomendable elevar la cabecera de la cama para reducir el riesgo de aparición28. Al tener un mecanismo de acción selectivo sobre los receptores alfa-1-adrenérgicos, no tiene efecto sobre la FC, y las reacciones adversas en el sistema nervioso central son infrecuentes. Puede asociarse a otros eventos adversos como piloerección y trastornos urinarios.
DROXIDOPA
La droxidopa (l-treo-3,4-dihidroxifenil-serina o l-DOPS) es un aminoácido sintético que, tras su administración oral, se transforma en NA mediante la acción de la dopa-descarboxilasa, que también cataliza la conversión de l-dopa a dopamina. El uso de droxidopa fue aprobado en 2014 por la FDA para el tratamiento del vértigo ortostático y la sensación de mareo en adultos con HOn asociada a la EP, la AMS y la neuropatía autonómica no diabética29–31. La Comisión Europea la categoriza como medicamento huérfano.
Su posología debe adaptarse a las características individuales de cada paciente. Es aconsejable su titulación lenta comenzando por una dosis de 100 mg, e incrementos progresivos de 100 mg tras 1,5-2 horas, hasta alcanzar la dosis máxima recomendada (600 mg tres veces al día). Es necesaria la supervisión de los síntomas de HO y las cifras de PA tras el incremento de dosis, y es recomendable tomarlo al menos 3 horas antes de acostarse para reducir el riesgo de hipertensión arterial supina.
PIRIDOSTIGMINA
La piridostigmina inhibe la acetilcolinesterasa, enzima que cataliza la hidrólisis de la acetilcolina, potenciado la neurotransmisión colinérgica en los ganglios autonómicos. Un estudio aleatorizado, doble ciego, mostró que la administración de 60 mg de bromuro de piridostigmina puede incrementar la PA en bipedestación, sin provocar hipertensión arterial supina32. Posteriormente un estudio aleatorizado, abierto, evidenció que el tratamiento en monoterapia o combinado de midodrina y piridostigmina es eficaz y seguro en pacientes con HOn, sin embargo la midodrina fue ligeramente superior a la piridostigmina en el tratamiento de los síntomas asociados a la HO33. En pacientes con EP, el tratamiento con bromuro de piridostigmina fue inferior a la fludrocortisona en el manejo de la HO34.
ATOMOXETINA
La atomoxetina es un inhibidor selectivo de la recaptación de NA en las neuronas presinápticas, aumentando su biodisponibilidad en los receptores alfa-1-adrenérgicos y mejorando la vasoconstricción. Por este motivo, puede ser útil para incrementar la PA, especialmente en pacientes con AMS, que poseen fibras noradrenérgicas simpáticas posganglionares intactas. Sin embargo, la atomoxetina no es una alternativa terapéutica eficaz en otros trastornos como la EP o la IAP35. Recientemente, un ensayo clínico aleatorizado, doble ciego y controlado con placebo no encontró superioridad frente a placebo en la reducción de síntomas de HOn a las 2 y 4 semanas del tratamiento con 10 o 18 mg de atomoxetina36.
OTROS FÁRMACOS
La eritropoyetina, en una dosis de 25-50 unidades/kg 3 veces/semana asociada a suplementos de hierro puede ser eficaz, especialmente en pacientes con HOn y anemia37. En aquellos pacientes que fracasan a los tratamientos comentados con anterioridad, la indometacina, la desmopresina o la octreótida pueden ser una alternativa terapéutica38,39. En algunos casos de HO grave se han utilizado marcapasos atriales e infusiones intravenosas intermitentes de NA, siendo necesaria en estos casos una evaluación adicional.
Financiación
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
Conflicto de intereses
La autora no comunica conflicto de intereses en relación con el contenido del trabajo.
Consideraciones éticas
Protección de personas y animales. La autora declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. La autora declara que no utilizó ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.