Introducción
Aproximadamente el 10% de la población puede tener una crisis a lo largo de su vida, aunque la máxima incidencia se da en niños, adolescentes y ancianos. Estudios poblacionales estiman que existe un 8-10% de riesgo de que un sujeto padezca una crisis en algún momento de su vida. La prevalencia de epilepsia en España en población adulta es de 14,87 casos por 1.000 habitantes1.
Cabe diferenciar dos tipos de crisis: crisis agudas sintomáticas, o provocadas, y crisis no provocadas, o remotas. Un grupo de crisis epilépticas (entre ellas el estado epiléptico) requieren de atención urgente, por lo que se denominan crisis urgentes.
Entre el 0,3 y el 1% de las consultas en urgencias se deben a crisis epilépticas o sospecha de crisis epiléptica. Es el tercer motivo de consulta neurológica en urgencias tras el ictus y la cefalea. Un 7% de los pacientes que inician con crisis lo hacen en forma de estado epiléptico. Un 3% de los transportes sanitarios urgentes son por crisis epilépticas. Concretamente en España, el estudio ACESUR evaluó la importancia de las crisis urgentes en servicios de urgencias. Fue un registro multicéntrico, prospectivo, de cohortes, multipropósito, que incluyó en 2017 a 17 servicios hospitalarios y 70 investigadores. Analizó el manejo de adultos con crisis epiléptica en servicios de urgencias hospitalarios y extrahospitalarios. Tuvo una fase de reclutamiento de 60 días y se evaluaron resultados a 30 días. De un total de 332.861 urgencias totales, se contabilizaron 1.371 crisis epilépticas (el 0,4% de las urgencias totales), de las que 661 fueron primeras crisis2.
Las crisis epilépticas o su sospecha son un motivo de consulta frecuente en urgencias. Esta revisión narrativa versa sobre su abordaje diagnóstico.
Crisis epiléptica: definición y tipos de crisis
Las crisis epilépticas consisten en un conjunto de signos y síntomas transitorios, secundarios a una actividad neuronal anormal, excesiva y sincrónica de las neuronas que se localizan en el córtex cerebral. La expresión clínica de las crisis epilépticas depende de la región cerebral afectada por la descarga neuronal excesiva. Si se afectan regiones motoras observaremos clonías, contracción tónica, desviación ocular o cefálica. Si afectan regiones o áreas visuales el paciente puede tener alucinaciones visuales, alteraciones en la percepción visual o alteraciones de campo visual, por ejemplo. Las crisis epilépticas son breves, tienen una duración media de 1-2 minutos. La fase de recuperación tras una crisis epiléptica se llama periodo poscrítico; en él, los síntomas son deficitarios: paresia, hipoestesia o afasia, por ejemplo. Este periodo suele tener una duración inferior a 30 minutos.
La ILAE (International League Against Epilepsy, Liga Internacional Contra la Epilepsia) clasifica las crisis epilépticas en cuatro grandes grupos: crisis de inicio focal, de inicio generalizado, de inicio desconocido y no clasificables. Dentro de cada uno de estos grupos las crisis se subclasifican en crisis con manifestaciones observables o no observables y crisis con consciencia preservada o alterada (Tabla 1)3.
Tabla 1. Versión actualizada de la clasificación de las crisis según la International League Against Epilepsy (ILAE)
| Inicio focal | Desconocido | Generalizado | No clasificable | |
|---|---|---|---|---|
| Consciencia preservada | Consciencia preservada | No motor | Motor | |
| Consciencia alterada | Consciencia alterada | Ausencia típicaAusencia atípicaAusencia mioclónicaMioclonía palpebral con o sin ausencia | MiocloníaMioclonía negativaCloníaEspasmo epilépticoTónicaMioclonía-atónicaAtónica | |
| Crisis focal a tónico-clónica bilateral | Crisis bilateral tónico-clónica | Crisis bilateral tónico-clónicaCrisis mioclónica-tónica-clónicaCrisis de ausencia a tónico-clónica | ||
| Añadir descriptores sobre la semiología a este tipo de crisis en orden cronológico | ||||
|
Adaptada de Beniczky et al.3. |
||||
Las crisis focales, generalizadas y de inicio desconocido pueden evolucionar a una crisis tónico-clónica bilateral. Se trata del tipo de crisis más grave y es el principal motivo de consulta en urgencias. Aunque se llaman tónico-clónicas bilaterales, afectan principalmente al córtex frontal y parietal de asociación, tálamo, ganglios de la base y tronco. Las crisis tónico-clónicas bilaterales tienen varias fases. Suelen iniciarse con una fase tónica a ritmo de 10 Hz que aumenta rápidamente de amplitud, seguida de una fase intermedia o vibratoria que se inicia en la musculatura distal, y acaba con una fase clónica a ritmo de 10 Hz, separada por intervalos inactivos, que disminuye en frecuencia y aumenta en amplitud, de manera que las clonías acaban siendo amplias y lentas. Durante la crisis existen cambios autonómicos que en ocasiones pueden ser graves, produciendo edema agudo de pulmón no cardiogénico, síndrome de takot-subo (cardiomiopatía de estrés) y otras complicaciones4.
Tras la crisis existe un periodo llamado poscritico donde la actividad cerebral cortical puede ser nula, observándose un aplanamiento difuso en el electroencefalograma (EEG). Clínicamente, en este periodo se puede observar que los reflejos pupilares están ausentes, los reflejos musculares profundos aumentados o que existe un reflejo cutáneo plantar extensor. A nivel sistémico se observa taquicardia, taquipnea e hipertensión. Es en esta fase cuando puede producirse la SUDEP (Sudden Unexpected Death in EPilepsy; muerte súbita inesperada en persona con epilepsia). La duración del periodo poscrítico tras una crisis tónico-clónica bilateral es de unos 30 minutos, pero puede llegar a durar 24 horas. Pasado el periodo poscrítico, es frecuente que el paciente refiera cefalea intensa, así como mialgias intensas que duran unos días.
Abordaje diagnóstico ante la sospecha de una crisis epiléptica
Anamnesis
La anamnesis siempre debe realizarse a un testigo directo. Deben hacerse las siguientes preguntas: inicio, duración, estado crítico y poscrítico, movimientos (versiones oculocefálicas, desviaciones, fluctuaciones en el movimiento, rigidez, clonías), amnesia posterior, mordedura de lengua y relajación de esfínteres. La presencia de cefalea, mialgias o dolor en hombro tras la crisis sugiere que el paciente ha sufrido una crisis epiléptica.
Exploración física
Además de la temperatura y la glucemia capilar, debe realizarse: toma de constantes (tensión arterial, frecuencia cardiaca, frecuencia respiratoria, saturación de oxígeno) y, si son anormales, repetirlas cada 5 minutos hasta su normalización; auscultación cardiaca y respiratoria; si el paciente está comatoso, movilización pasiva de extremidades y palpación de tórax y columna buscando posibles fracturas o luxaciones. Si es posible, se recomienda la monitorización del paciente, especialmente en pacientes comatosos o poscríticos.
Exploración neurológica
Debe hacerse una exploración neurológica completa buscando focalidad (afasia, hemiparesia, hemihipoestesia, extinciones, reflejo cutáneo plantar extensor, etc.). Es recomendable explorar al paciente repetidamente hasta su completa recuperación, por lo que no debe dejarse a un paciente en estado poscrítico sin evaluar durante horas.
Precauciones y consideraciones ante un paciente que ha sufrido una crisis epiléptica
Tras haber sufrido una crisis tónico-clónica bilateral en medio extrahospitalario o en urgencias, y mientras el paciente esté poscrítico, se recomienda la aspiración de mucosidades, mantenerlo en postura de seguridad (decúbito lateral) y administrar oxígeno. Se cree que la SUDEP se produce en el periodo poscrítico tras una crisis convulsiva motora bilateral. La gravedad del estado poscrítico y la inmovilidad tras la crisis son factores de riesgo de sufrir SUDEP5.
Analítica general
Tras una crisis epiléptica, o tras un episodio sospechoso de crisis epiléptica, una determinación en suero y orina de diversos metabolitos es útil por tres motivos: diagnóstico diferencial entre crisis epilépticas y otros episodios no epilépticos; establecer la causa en crisis sintomáticas agudas, y determinar si existe riesgo de complicaciones como rabdomiólisis, cardiomiopatías o insuficiencia renal aguda. En la tabla 2 se describen las pruebas analíticas que realizar en caso de sospecha de crisis epiléptica6,7.
Tabla 2. Determinaciones que solicitar en una analítica en paciente que ha tenido una crisis epiléptica o episodio con sospecha de crisis epiléptica
| Diagnóstico diferencial | Causa | Complicaciones |
|---|---|---|
| Prolactina | Glucosa, sodio, potasio, calcio, magnesio, fósforo | CK, troponinas cardiacas, péptido natriurético |
| CK | Urea, creatinina, enzimas hepáticos (GOT, GPT), bilirrubina | Ácido úrico |
| Lactato | Tóxicos en orina: cocaína, anfetaminas, cannabinoides, fenciclidina, ketamina | GPT, GOT |
| pH | Metales pesados, monóxido de carbono, herbicidas, fármacos (neurotoxicidad) | |
| Amonio | Fármacos anticrisis (en pacientes con epilepsia conocida) | |
| Leucocitos con fórmula | Sospecha de infección: cultivos, serologías; PCR en sangre, orina e incluso LCR | |
|
CK: creatincinasa; GOT: aspartato aminotransferasa; GPT: alanina aminotransferasa; LCR: líquido cefalorraquídeo; PCR: proteína C reactiva. |
||
En pacientes epilépticos en tratamiento con fármacos anticrisis (FAC), la determinación de niveles plasmáticos del FAC prescrito ayuda a valorar su cumplimiento. El mal cumplimiento es una de las principales causas de descompensación en pacientes epilépticos.
Electrocardiograma
Se recomienda realizar un electrocardiograma tras crisis tónico-clónicas bilaterales, pues pueden inducir un síndrome de takot-subo. Debe pensarse en este síndrome en caso de hipotensión o desaturación inexplicada durante o tras una crisis epiléptica. Simula un síndrome coronario agudo en forma de infarto agudo de miocardio de cara anterior con clínica compatible, elevación del segmento ST y de marcadores de isquemia miocárdica.
El síndrome de takot-subo es causa de muerte súbita. Se desencadena por liberación masiva de catecolaminas en sangre que producen vasoespasmo de arterias coronarias3. Puede aparecer entre 1 y 12 horas tras una crisis o un estado epiléptico y, en general, tiene buen pronóstico a largo plazo.
Radiografía de tórax
Se recomienda realizar tras crisis tónico-clónica bilateral, pues puede desencadenar un edema agudo de pulmón no cardiogénico. Esta complicación se produce por activación del sistema simpático y lesión del endotelio capilar. Existe una forma temprana (minutos/horas) y una forma tardía (12-24 horas).
Neuroimagen
La probabilidad de detectar anomalías significativas con tomografía computarizada (TC) o resonancia magnética (RM) tras una primera crisis no provocada es baja, del 10% (nivel de certeza II). Sin embargo, debe realizarse una prueba de neuroimagen en todo paciente con una primera crisis (grado de recomendación B, Guía de Epilepsia de la Sociedad Española de Neurología 2019)7, a excepción de sospecha firme de epilepsia parcial benigna de la infancia o epilepsia generalizada idiopática (grado de recomendación C)8. La RM es la prueba de elección en el paciente con epilepsia (grado de recomendación C), mientras que la TC debe limitarse a situaciones de urgencia o cuando la RM está contraindicada (grado de recomendación D)8.
En los pacientes con epilepsia conocida, tras una crisis, habitualmente no se requiere de TC craneal urgente a no ser que se cumpla alguno de estos supuestos: antecedentes de cáncer, tratamiento con anticoagulantes, déficit focal persistente, sospecha de inmunosupresión, cambio en la semiología o la frecuencia de las crisis, traumatismo craneal reciente, estado poscrítico persistente, cefalea persistente, focalidad neurológica nueva o fiebre sin foco.
En la actualidad se indica TC craneal de perfusión (Fig. 1) urgente en pacientes con focalidad neurológica y sospecha de ictus, así como en pacientes con sospecha de vasoespasmo tras una hemorragia subaracnoidea. La TC craneal de perfusión es útil en el diagnóstico del estado epiléptico, especialmente si el diagnóstico diferencial es un poscrítico prolongado. En este caso, tiene una sensibilidad del 78% y una especificidad del 95%9,10.
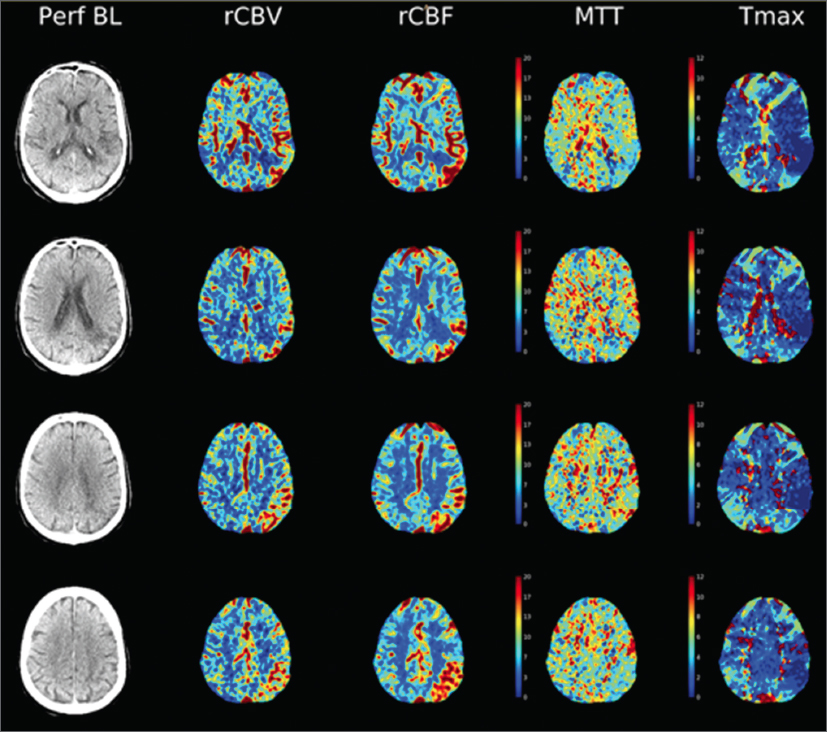
Figura 1. TC simple y de TC de perfusión de paciente con clínica de afasia brusca. En la TC simple se observa una lesión malácica en territorio temporal posterior correspondiente a secuelas de un ictus isquémico previo. En la TC de perfusión se observa aumento de flujo (rCBV y rCBF) y disminución de Tmáx y de MTT en los alrededores de la lesión isquémica antigua correspondiendo a un foco ictal. El paciente fue diagnosticado de estado epiléptico afásico de causa vascular. TC: tomografía computarizada.
Electroencefalograma
La realización de un EEG (Fig. 2) lo antes posible tras una crisis detecta descargas epileptiformes intercríticas con más frecuencia que un registro demorado más de 24-48 horas (nivel de evidencia I, Guía de Epilepsia de la Sociedad Española de Neurología 2019)8. En el caso de una primera crisis tiene valor pronóstico y puede establecer el diagnóstico de epilepsia y la necesidad de tratamiento con FAC.
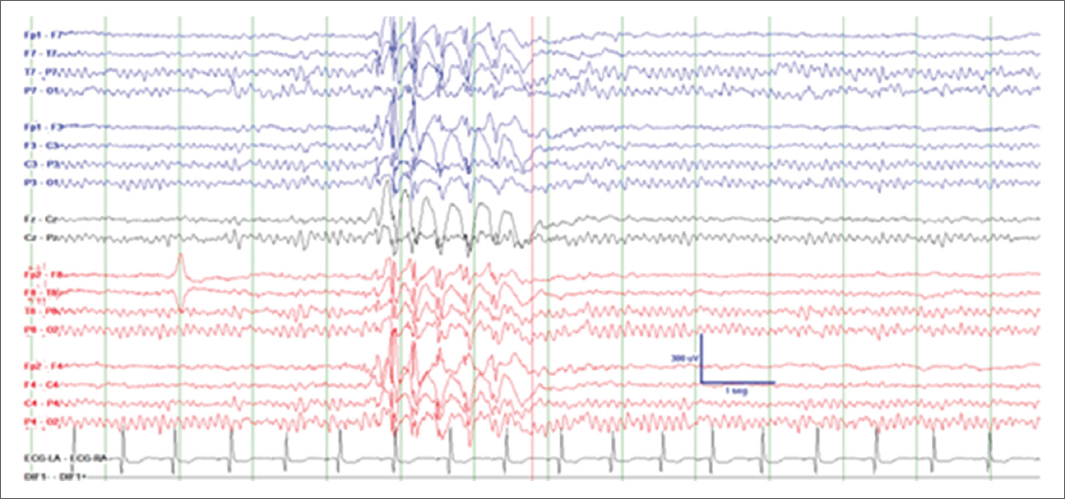
Figura 2. Paciente de 18 años que presenta crisis motora con evolución a crisis tónico-clónica bilateral. EEG (montaje bipolar) realizado a las 12 horas que muestra actividad de fondo normal y presencia de descargas epileptiformes generalizadas en forma de punta-onda a 3,5 Hz sugestivas de epilepsia generalizada idiopática. El EEG es diagnóstico para epilepsia, por lo que el paciente debe iniciar tratamiento con fármacos anticrisis. EEG: electroencefalograma.
Debe realizarse un EEG urgente a todo paciente con sospecha de estado epiléptico no convulsivo, alteración del nivel de consciencia no explicada por otras causas o en caso de no recuperación tras el tratamiento de un estado epiléptico convulsivo.
Estudio del líquido cefalorraquídeo
Tras una crisis epiléptica, el estudio del líquido cefalorraquídeo (LCR) no acostumbra a estar indicado. Únicamente se valorará su necesidad en las siguientes situaciones: sospecha de encefalitis/meningitis infecciosa, sospecha de encefalitis/meningitis autoinmune y en pacientes con neoplasia activa y sospecha de invasión meníngea. En todos los casos debe realizarse primero una TC craneal y en el último supuesto (sospecha de invasión meníngea), se requiere estudio del LCR por citometría de flujo, prueba que no se realiza habitualmente de urgencias. Un recuento celular > 5 leucocitos en LCR se considera patológico y solo se observa en el 4-10% de los pacientes tras una crisis de causa no infecciosa/inflamatoria11.
Otras pruebas
RADIOGRAFÍA DE COLUMNA O EXTREMIDADES
En pacientes que hayan sufrido caídas o traumatismos, si existe limitación en la movilización de extremidades o dolor persistente lumbar, dorsal, en cadera o en hombro, es recomendable realizar una placa para descartar fracturas o luxaciones.
ANALÍTICAS SERIADAS PARA EVALUAR LA FUNCIÓN RENAL
En pacientes con niveles de creatincinasa (CK) superiores a 5.000 U/l debe hacerse un seguimiento durante 3 días debido al riesgo de insuficiencia renal secundaria. La escala McMahon predice el riesgo de insuficiencia renal aguda según una serie de ítems: edad, sexo, creatinina, calcio y fosfato inicial, CK superiores a 40.000 U/l o no, y causa. Con una puntuación superior a 10, el riesgo es del 61%12.
Diagnóstico diferencial
Los diagnósticos con los que más frecuentemente se confunden las crisis epilépticas son los síncopes y los trastornos paroxísticos no epilépticos (TPNE) psicógenos, pero existen muchas otras causas que deben considerarse ante un paciente con sospecha de crisis epiléptica. En la tabla 3 se describen los principales diagnósticos diferenciales agrupados por edades.
Tabla 3. Diagnósticos diferenciales más frecuentes en pacientes con sospecha de crisis epiléptica
| Niños de 0-3 años | Niños de 3-6 años | Niños de 6-12 años | Adolescentes | Adultos y ancianos |
|---|---|---|---|---|
| Espasmos de sollozo | Terrores nocturnos | Trastornos de sueño | Síncopes | Accidente isquémico transitorio |
| Síndrome de sobresalto | Rabietas | Migraña abdominal o basilar | Trastornos de sueño | TPNE psicógenos |
| Síndrome de Sandifer | Tics | Migraña con aura | Amnesia global transitoria | |
| Vértigo paroxístico benigno | Coreoatetosis paroxística cinesigénica | TPNE psicógenos | Síncopes | |
| Mioclono benigno de la infancia | Trastornos de sueño | |||
|
TPNE: trastornos paroxísticos no epilépticos. |
||||
Síncopes vs. crisis convulsivas tónico-clónicas bilaterales
Los síncopes convulsivos pueden confundirse con una crisis motora convulsiva bilateral. Además de por las características clínicas diferenciales agrupadas en la escala de Sneddon13, los hallazgos analíticos como elevación de CK, leucocitosis y neutrofilia, que se observan en las crisis epilépticas y no en los síncopes convulsivos, pueden ser de ayuda. La escala de Sneddon tiene una sensibilidad y especificidad del 94% para los siguientes puntos de corte: para crisis epiléptica, superior o igual a 2; para síncope, inferior a 1. Si se obtiene 1 punto, el resultado no es concluyente.
TPNE psicógeno vs. crisis convulsivas tónico-clónicas bilaterales
La tabla 4 recoge las diferencias semiológicas entre los TPNE psicógenos y las crisis epilépticas convulsivas. La diferencia más importante que recordar es que un TPNE psicógeno no conlleva riesgo de producir daño cerebral ni inestabilidad hemodinámica o respiratoria.
Tabla 4. TPNE de origen psicógeno y crisis epilépticas convulsivas: características clínicas diferenciales
| Características | TPNE psicógeno | Crisis epilépticas convulsivas |
|---|---|---|
| Inicio gradual y fluctuante | Común | Raro |
| Larga duración (> 15 minutos) | Común | Raro |
| Llantos, vocalizaciones o quejidos ictales | Común | Raro, excepto sonidos guturales de expulsión de aire |
| Movimientos pélvicos | Ocasional | Raro |
| Movimientos de lado a lado de cabeza | Común | Raro |
| Movimientos de extremidades desorganizados y sin un patrón estereotipado | Común | Raro |
| Ojos cerrados y resistencia a la apertura | Común | Raro |
| Conducta de autoagresión (morderse, arañarse, darse puñetazos) | Ocasional | Raro |
| Episodios de «estados epilépticos» recurrentes | Común | Raro |
| Complicaciones: traumatismos, fracturas, luxaciones | Ocasional | Común |
| Respuesta a tratamiento anticrisis | Errática | Común |
| Hipertensión, desaturación y acidosis durante la crisis | Raro | Común |
| Historia de traumas psicológicos graves | Común | Ocasional |
| Comienzo antes de los 10 años | Raro | Común |
|
TPNE: trastornos paroxísticos no epilépticos. |
||
Crisis epiléptica urgente
Se define como crisis epiléptica urgente14 a aquella crisis que, por sus características, requiere ser atendida de forma preferente, bien porque puede provocar daño cerebral, bien porque puede evolucionar a un estado epiléptico, como las crisis de alto riesgo y las crisis en acúmulos (cluster) (Tabla 5).
Tabla 5. Tipos de crisis epilépticas urgentes
| Primera crisis |
| Crisis de alto riesgo |
| Crisis en gestante |
| Crisis en paciente con epilepsia que no toma el tratamiento desde ≥ 24 horas |
| Estado epiléptico |
| Crisis agrupadas |
| Crisis más enfermedad psiquiátrica grave |
| Crisis más fiebre |
| Crisis más traumatismo craneoencefálico |
Dentro de las crisis epilépticas urgentes se incluyen las crisis de alto riesgo. Son aquellas que puntúan más de 1 en la escala ADAN o más de 2 en la escala RACESUR. La escala ADAN es una escala que evalúa, a nivel prehospitalario, el riesgo de evolucionar a un estado epiléptico en pacientes que han sufrido una crisis motora bilateral. Valora los siguientes ítems: lenguaje, desviación ocular, automatismos y número de crisis15.
La escala RACESUR indica un probable resultado adverso (recurrencia de crisis que requiere consulta a urgencias, hospitalización o muerte) a los 30 días de ser dado de alta del servicio de urgencias. Esta escala valora los siguientes ítems: tipo de crisis, consumo habitual de tres o más FAC y visitas a urgencias hospitalarias en el semestre anterior16.
Además de las crisis de alto riesgo, se consideran también crisis epilépticas urgentes las crisis que se repiten en acúmulos y el estado epiléptico.
Crisis en acúmulos
Son más frecuentes en pacientes con epilepsia extratemporal, farmacorresistente y de larga evolución. Tiene varias definiciones: tres o más crisis en 24 horas, dos o más crisis en 24 horas, más de dos crisis en 6 horas. En caso de crisis epiléptica grave en que el paciente no esté en su estado basal (sin focalidad neurológica y sin repetir crisis), se recomienda la realización de EEG urgente (en menos de 1 hora). Si en el EEG urgente se registran crisis o es diagnóstico de estado epiléptico, se recomienda realizar vídeo-EEG continuo para valorar respuesta a FAC y la evolución. Si el EEG muestra un patrón no diagnóstico de estado epiléptico definitivo, sino probable, se realizará vídeo-EEG continuo para valorar respuesta a FAC y TC craneal de perfusión para confirmar o descartar el diagnóstico de estado epiléptico.
Estado epiléptico
El estado epiléptico es una crisis anormalmente larga17. Es consecuencia del fallo de los mecanismos responsables de la finalización de las crisis y/o del inicio de los mecanismos que conducen a crisis anormalmente prolongadas (después del tiempo T1). Puede tener consecuencias a largo plazo después del tiempo T2, incluyendo alteración de redes neuronales, muerte neuronal y lesión neuronal dependiendo del tipo y duración de las crisis.
T1 es el tiempo de duración de la crisis a partir del cual estaríamos ante un estado epiléptico. T2 es tiempo de duración de la crisis a partir del cual se produce daño neuronal que puede ser irreversible. T1 y T2 difieren entre los distintos tipos de estado epiléptico. El tiempo T1 es de 5 minutos para el estado epiléptico convulsivo bilateral, de 10 minutos para el estado epiléptico focal con alteración de consciencia y de 15 minutos para el estado de ausencia. En relación con el tiempo T2, es de 15 minutos para el estado epiléptico convulsivo bilateral y de 30 minutos para el focal con alteración de consciencia.
EEG Y VÍDEO-EEG PROLONGADO EN PACIENTES EN ESTADO EPILÉPTICO
En caso de crisis epiléptica grave donde el paciente no se encuentre en su estado basal (sin focalidad neurológica y sin repetir crisis), se recomienda la realización de EEG urgente (en menos de una hora). Si en el EEG se registran crisis o es diagnóstico de estado epiléptico, se realizará vídeo-EEG continuo para valorar la respuesta a FAC y la evolución. Tal como se ha dicho más arriba, si el EEG muestra un patrón no diagnóstico de estado epiléptico definitivo, sino probable, se realizará vídeo-EEG continuo para valorar respuesta a FAC, y una TC craneal de perfusión para confirmar la sospecha de estado epiléptico.
PRONÓSTICO DEL ESTADO EPILÉPTICO
Existen varias escalas que evalúan el pronóstico del estado epiléptico en el momento del ingreso. La escala STESS18 y la escala mSTESS19, que incorpora la puntuación Rankin basal del paciente al ingreso, evalúan el pronóstico del paciente en estado epiléptico en el momento del inicio. Puntúa de 0 a 8, indicando probable muerte tras el ingreso un valor superior a 4.
Crisis epiléptica sintomática aguda
La crisis epiléptica sintomática aguda (CSA) sintomática se define como aquella crisis que se produce en estrecha relación con una afectación sistémica o cerebral. Un 34% de las crisis afebriles son crisis sintomáticas agudas. Aumentan el riesgo de desarrollo posterior de crisis sintomáticas remotas o de epilepsia20. Además, empeoran el pronóstico funcional del paciente que las sufre. En algunos casos, como los pacientes que han sufrido un ictus, aumentan la mortalidad. Las CSA prolongadas o el estado epiléptico incrementan más el riesgo de epilepsia posterior. Estas crisis dependen del umbral convulsivógeno de cada paciente. Algunas se definen por su relación temporal con la noxa; otras por el valor de la alteración en el caso de una causa metabólica (Tabla 6).
Tabla 6. Orientación diagnóstica de las crisis sintomáticas agudas asociadas a diversas afecciones20
| Procesos estructurales del SNC | Relación temporal |
|---|---|
| Enfermedad cerebrovascular, TCE, tras cirugía intracraneal | 7 días |
| Infecciones víricas del SNC | 7 días |
| Anoxia cerebral | 7 días |
| Hematoma subdural | Hasta 1 mes |
| Malformación arteriovenosa | Mientras se mantenga la hemorragia |
| Neurocisticercosis | Parásitos en fase transicional o degenerativa |
| Malaria | Mientras persista la fiebre |
| Tuberculosis | En abscesos, mientras se mantenga |
| Esclerosis múltiple | En los primeros 7 días del brote |
| Encefalitis inmunomediada | Mientras se mantenga la fase inflamatoria |
| Trastornos metabólicos y tóxicos agudos | Valores diagnósticos y relación temporal |
| Hipoglucemia | < 35 mg/dl |
| Hiperglucemia | > 450 mg/dl + cetoacidosis |
| Hiponatremia | < 115 mg/dl |
| Hipocalcemia | < 5 mg/dl |
| Hipomagnesemia | < 0,8 mg/dl |
| IR: urea, creatinina | > 100 mg/dl, >10 mg/dl |
| Durante el curso del trastorno | |
| Privación de alcohol | 7-48 horas desde la última toma |
| Privación de barbitúricos y benzodiazepinas | Según vidas medias |
| Tóxicos: cocaína o crack | Si se encuentran metabolitos en sangre u orina |
| Fármacos | |
|
IR: insuficiencia renal; SNC: sistema nervioso central; TCE: traumatismo craneoencefálico. |
|
Un subtipo de estas crisis, descrito más recientemente, lo conforman las CSA asociadas a encefalitis autoinmune21. Se producen durante la fase aguda o inflamatoria de una encefalitis autoinmune. Una encefalitis autoinmune puede tener una fase inflamatoria de varios meses, por lo que las crisis pueden presentarse durante todo este tiempo. Las más frecuentes se asocian a los siguientes anticuerpos: GABABR, AMPAR, onconeuronales, GAD, NMDAR, LGI1, CASPR y mGLUR5. Algunas crisis son muy características, como las crisis facio-braquio-distónicas en la encefalitis por LGI1. Habitualmente no responden a FAC, sí a tratamiento inmunomodulador, que debe iniciarse de la forma más precoz posible.
Crisis sintomáticas agudas tras un ictus
Las CSA tras un ictus22 suelen producirse en las primeras 24 horas. Un 15% de estas CSA recurrirán en las primeras 3 semanas. En comparación con personas de la misma edad, sexo y gravedad del ictus que no han sufrido CSA, duplican la mortalidad a los 30 días. Un tercio de los pacientes que han sufrido CSA tras un ictus desarrollarán epilepsia. Son factores de riesgo para sufrir CSA tras un ictus: afectación cortical, presencia de sangre cortical y subaracnoidea, ictus de territorio anterior, tratamientos de reperfusión (trombectomía, endarterectomía carotídea, fibrinólisis) y que estos tratamientos hayan sido eficaces.
Crisis sintomáticas agudas de origen tóxico-metabólico
CRISIS SINTOMÁTICA AGUDA POR PRIVACIÓN DE ALCOHOL
Crisis que aparecen entre las 8 y las 48 horas tras la toma de la última bebida alcohólica. Habitualmente son crisis convulsivas bilaterales. En estos casos, el EEG no suele mostrar actividad epileptiforme. Pueden aparecer en acúmulos y existe más riesgo de que se repitan si se han sufrido previamente23.
CRISIS SINTOMÁTICA AGUDA POR CONSUMO CRÓNICO DE ALCOHOL (SÍNDROME SESA)
Este tipo de crisis asociadas al consumo crónico de alcohol se ha descrito más recientemente24. El síndrome SESA (Subacute Encephalopathy with Seizures in Alcoholics) se presenta con crisis focales y focalidad neurológica aguda en forma de hemiparesia o hemianopsia que, característicamente, cursa como un periodo poscrítico muy prolongado. El EEG puede mostrar actividad delta focal o descargas lateralizadas periódicas. La neuroimagen muestra afección vascular multifocal en diferentes fases y puede haber captación de contraste leptomeníngea y parenquimatosa. Requiere de tratamiento crónico.
CRISIS SINTOMÁTICA AGUDA POR PRIVACIÓN DE BENZODIAZEPINAS, OTROS GABAÉRGICOS Y BARBITÚRICOS
El uso crónico de benzodiazepinas produce tolerancia y dependencia, y su supresión brusca puede producir crisis tanto focales como generalizadas.
El flumazenil es un antagonista de las benzodiazepinas que se emplea para revertir rápidamente los efectos de las benzodiazepinas en caso de intoxicación aguda. Su administración puede desencadenar crisis epilépticas en pacientes epilépticos, pero también en pacientes que además hayan consumido antidepresivos tricíclicos, cocaína, litio, isoniazida, inhibidores de la monoaminooxidasa, bupropión y ciclosporina, dado que son fármacos o tóxicos que disminuyen el umbral convulsivógeno. Se está empleando flumazenil en infusión a dosis bajas para el tratamiento de la dependencia crónica a benzodiazepinas, pero dado su posible potencial convulsivógeno, incluso en pacientes sin antecedentes de epilepsia, debe administrarse junto con un fármaco fármaco anticrisis.
CRISIS SINTOMÁTICA AGUDA POR PRIVACIÓN DE BACLOFENO
El baclofeno es un agonista del receptor GABAB que se utiliza como relajante muscular. Puede administrarse por vía oral y en perfusión continua intratecal. Esta última vía se emplea en el tratamiento de la espasticidad en pacientes con esclerosis múltiple y otras enfermedades. Su brusca supresión puede producir hipertermia, hipertensión, delirio, insuficiencia respiratoria, hipertonía generalizada, crisis epilépticas, estado epiléptico e inestabilidad hemodinámica. Se trata de una situación grave que puede ser mortal, y puede simular un síndrome serotoninérgico. Debe tratarse con diazepam endovenoso, pudiéndose asociar ciproheptadina oral.
CRISIS POR TOXICIDAD DE INMUNOSUPRESORES Y QUIMIOTERÁPICOS
Estos agentes farmacológicos pueden provocar un síndrome de encefalopatía posterior reversible25. Se trata de una afectación del sistema nervioso central, pudiendo incluir la médula espinal e incluso el sistema nervioso periférico, de inicio agudo o subagudo. Se caracteriza por: cefalea, síntomas visuales, alteración de la consciencia, confusión, crisis epilépticas, estado epiléptico (en la mayoría de los casos no convulsivo) y déficits neurológicos focales. La mayoría de los pacientes además presentan hipertensión arterial grave. Su tratamiento es sintomático: retirar el fármaco causante, controlar la hipertensión, tratar la enfermedad autoinmune que lo produce, etc. Debe realizarse diagnóstico diferencial con: trombosis venosa cerebral, hemorragia subaracnoidea, ictus isquémico de territorio posterior, encefalitis o meningitis, etc.
CRISIS SINTOMÁTICA AGUDA POR TOXICIDAD DE CEFALOSPORINAS ASOCIADA A INSUFICIENCIA RENAL
Las cefalosporinas se han asociado con diversas manifestaciones neurológicas como cefalea y mareo, déficit atencional, encefalopatía, pero también con crisis epilépticas de todo tipo: focales motoras con o sin generalización secundaria, focales no motoras con o sin alteración de consciencia, e incluso estado epiléptico no convulsivo26.
Por otra parte, se sabe que la insuficiencia renal provoca un aumento de la permeabilidad de la barrera hematoencefálica, aumentando la concentración de la cefalosporina en el LCR. Además, las cefalosporinas podrían tener un antagonismo competitivo con el GABA, dado que una porción del antibiótico es parecida a un antagonista del GABA (bicuculina), provocando además disminución de la liberación de GABA y liberación de endotoxinas, citocinas y factor de necrosis tumoral alfa.
CRISIS SINTOMÁTICA AGUDA ASOCIADAS A TRASTORNOS METABÓLICOS
Los trastornos iónicos que más frecuentemente provocan crisis epilépticas son la hiponatremia, la hipomagnesemia, la hipocalcemia y la hipofosfatemia. Estas CSA se producen en el contexto de una encefalopatía que cursará con alteración de consciencia (desde inatención a coma), alteración del ritmo sueño-vigilia y del estado de alerta.
El 14-33% de los pacientes con uremia presentan crisis, que pueden ser focales o generalizadas (en caso de lesión subyacente). Deben diferenciarse de la asterixis y las mioclonías multifocales asociadas a la encefalopatía urémica. Son más frecuentes en la insuficiencia renal aguda (generalmente, con filtrado < 10% de lo normal), en asociación con desequilibrios hidroelectrolíticos (como la hiponatremia) y en pacientes con síndrome hepatorrenal (se reduce el lavado de amonio). Los niveles de urea y creatinina no se relacionan de forma directa con la clínica. Se cree que las toxinas osmóticamente activas deben ser moléculas hidrosolubles de pequeño a moderado tamaño. Los cambios característicos en el EEG incluyen enlentecimiento difuso, theta focal rítmico intermitente y ondas delta y/o trifásicas paroxísticas bilaterales. El tratamiento es el de la causa (hemodiálisis, corrección de electrolitos o trasplante renal).
Finalmente, hasta un tercio de los pacientes con encefalopatía hepática grado III/IV pueden presentar CSA e incluso estado epiléptico no convulsivo. La encefalopatía hepática cursa con edema cerebral. El amonio, al atravesar barrera hematoencefálica, se transforma en glutamina, que es osmóticamente activa. El acúmulo de manganeso a nivel cerebral también podría ser neurotóxico27. Este tipo de CSA pueden pasar desapercibidas, dado que los pacientes presentan estupor o coma por la encefalopatía hepática. Su diagnóstico es por monitorización EEG continua y técnicas de neuroimagen, en las que se observan alteraciones corticales en difusión, FLAIR y perfusión. El tratamiento de la encefalopatía hepática se basa en la disminución del amonio sistémico y en medidas antiedema cerebral.
Conclusiones
En los servicios de urgencias, las crisis epilépticas o su sospecha son un motivo de consulta frecuente. Las crisis convulsivas tónico-clónicas bilaterales requieren de seguimiento estrecho en urgencias dadas sus posibles complicaciones posteriores. Algunas crisis, como las crisis de alto riesgo, la primera crisis o el estado epiléptico, requieren de un abordaje diagnóstico y terapéutico urgente para evitar complicaciones agudas y el desarrollo posterior de epilepsia o de daño cerebral permanente.
Financiación
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido. El presente trabajo procede de una publicación de un curso online de la Sociedad Española de Neurología titulado Código Crisis.
Conflicto de intereses
La autora no comunica conflicto de intereses en relación con el contenido del trabajo.
Consideraciones éticas
Protección de personas y animales La autora declara que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial La autora declara que no utilizó ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.