INTRODUCCIÓN
La humanidad ha necesitado medir el tiempo desde los comienzos de la historia. La observación de ciclos repetidos en el entorno motivó a los primeros humanos a diseñar una medida que permitiera cuantificar los ritmos de las estaciones y los días. Aunque ahora nos lamentemos de la esclavitud que suponen los horarios, en su momento la medición del tiempo podía anticipar sucesos, como la caída de la noche o la llegada del invierno, lo que suponía para aquellos humanos una ventaja evolutiva.
Si observamos a nuestro alrededor, es evidente que los ritmos dominan el mundo en el que vivimos. Y es que estos relojes no solo se encuentran en el exterior, sino que también están impresos en nosotros, persistiendo incluso en ausencia de nuestros indicadores mecánicos (ahora digitales) del paso del tiempo. Los antiguos griegos ya eran conscientes de los ritmos, presentes en la migración de aves, la estacionalidad de enfermedades, el ciclo sueño-vigilia y más, que rigen nuestra vida y eran en el pasado la herramienta para evaluar el tiempo. Se distinguía entonces entre el tiempo lineal objetivo (khronós, χρόνος) del tiempo subjetivo u oportunidad (kairós, καιρός) y del tiempo cíclico (aión, αἰών). El tiempo cíclico era el tiempo que volvía y estaba representado por las estaciones y los días. Tal vez por el hecho de ser el más evidente, en medicina hayamos olvidado este último, habiéndole dedicado menos tiempo a su estudio del que realmente merece.
Si los ciclos son una obviedad, su razón evolutiva no lo es tanto. Se cree que estos ritmos nacieron como método de nuestro organismo para predecir el exterior. Es como si los ritmos de nuestro medio quedasen impresos en nuestra biología bajo la fuerza evolutiva, provocando que aquellos individuos que anticipaban su sueño a la noche o consiguiesen ponerse a cobijo en el invierno lograsen transmitir sus genes a la descendencia.
Sin embargo, a pesar de la evidencia de que no todos los procesos biológicos son constantes, la ciencia en un afán simplificador ha intentado explicarlos como si así lo fueran. Está tan integrado en la farmacología que la eficacia de los medicamentos solo depende del compuesto, la dosis y la vía, que a veces es fácil olvidar que esto no es así. Por ejemplo, se sabe que una misma dosis letal 50 (aquella dosis que acaba con el 50% de los individuos) administrada a diferentes horas del día en ratones no es la misma1 o que los pacientes operados en turno de mañana en una cirugía de sustitución valvular aórtica tienen mayor supervivencia que los de turno de tarde, incluso hasta cuatro años después2.
La cronofarmacología, como disciplina englobada en la cronoterapéutica, es la ciencia que se encarga de conocer cómo estas variaciones pueden influir en la respuesta a los medicamentos y, por ende, en la eficacia terapéutica. En el contexto de las enfermedades neurológicas, esta interrelación entre el reloj biológico humano, cuyo marcapasos reside en el sistema nervioso y la farmacoterapia, adquiere una relevancia crítica.
Así, si tenemos en cuenta la cronofarmacología, un tratamiento será adecuado solo si está adaptado a los ritmos del paciente. Debemos tener en cuenta tanto el cronotipo de los pacientes, es decir, el propio ritmo de cada individuo, como aspectos biológicos relacionados con la sensibilidad a los efectos de los fármacos. Estos aspectos biológicos comprenden: la cronestesia, el cambio en los mecanismos de acción de los fármacos debido al reloj interno; la cronocinética, cambios en la concentración plasmática por diferencias en la absorción, metabolización y eliminación de los fármacos; y la cronergía, la suma de la cronocinética y cronestesia, es decir, los cambios en los efectos de los fármacos sobre el organismo (Tabla 1). Además, la cronofarmacología no solo tiene en cuenta la respuesta fisiológica, sino que considera las variaciones debidas a la propia enfermedad.
TABLA 1. Glosario de términos
| Término | Definición |
|---|---|
| Cronoterapia | Régimen terapéutico basado en los ciclos circadianos del paciente. Puede estar relacionado con la farmacología u otras manipulaciones del reloj interno o pistas externas |
| Cronergía | Representa el cambio en la respuesta del organismo de acuerdo con la cronestesia y la cronocinética |
| Cronestesia | Cambios temporales que ocurren en el mecanismo de acción de un fármaco y en los efectos de las medicaciones |
| Cronocinética | Cambios en la absorción, metabolización y eliminación de los fármacos con el tiempo |
| Zeitgebers | Entradas del sistema circadiano que alteran la ritmicidad de las oscilaciones biológicas. Entre ellas, la luz es el sincronizador más potente de los ritmos circadianos |
El propósito de este artículo es explorar cómo el momento de administración de medicamentos puede modular su eficacia y tolerabilidad en el contexto de las enfermedades neurológicas. Mediante la comprensión de cómo los ritmos biológicos impactan en la farmacocinética y farmacodinamia, los tratamientos pueden ser adaptados al individuo, diseñando terapias a medida de cada uno. Es sorprendente que el desarrollo de la tan cacareada medicina de precisión pueda pasar por algo tan simple como adaptar los fármacos a las horas del día.
En esta revisión se abordan los diferentes mecanismos circadianos de la enfermedad y cómo pueden ser afectados por la farmacología. Para aquellos lectores interesados en profundizar en el funcionamiento del reloj interno se recomienda consultar las extensas revisiones realizadas al respecto.
EL RELOJ COMO CAUSA DE ENFERMEDAD
Aunque la existencia de una ritmicidad en la conducta humana y en la biología era conocida desde la antigüedad, no fue hasta los años 80 del pasado siglo cuando se demostró la existencia de un ritmo biológico. Los experimentos llevados a cabo por Aschoff demostraron que existía un ritmo endógeno de sueño-vigilia y de temperatura corporal independiente del medio externo. Para validarlo, aisló a los sujetos dentro de búnkeres en ausencia de sincronizadores externos como la luz, y observó qué ocurría con los ritmos sueño-vigilia. En dichos estudios, Aschoff apreció que la periodicidad de los ciclos era intrínseca para cada individuo y además era ligeramente superior a las 24 horas, lo que ocasionaba un leve desfase respecto al día ambiental3,4.
Localizar el generador del ritmo endógeno fue otra tarea compleja y aún no del todo dilucidada, pues según el sistema y la función a la que nos refiramos la explicación puede ser diferente. Se sabe que el marcapasos central reside en el hipotálamo anterior, en el denominado núcleo supraquiasmático (NSQ) (Fig. 1). Este núcleo está compuesto por varios grupos de neuronas que tras el nacimiento presentan cada una de ellas una frecuencia de pulso independiente. Esta desincronización y su interferencia ocasiona múltiples periodos que, superpuestos, imponen un ritmo sueño-vigilia caótico y mucho más corto que el día, lo que explica los ciclos erráticos de los recién nacidos. Sin embargo, a partir del sexto mes, la frecuencia de disparo de estas neuronas va acoplándose, de tal modo que adquieren la cadencia propia del adulto. Con el envejecimiento, la periodicidad de estas neuronas vuelve a perder el ritmo común, retornando a adoptar un patrón ultradiano.
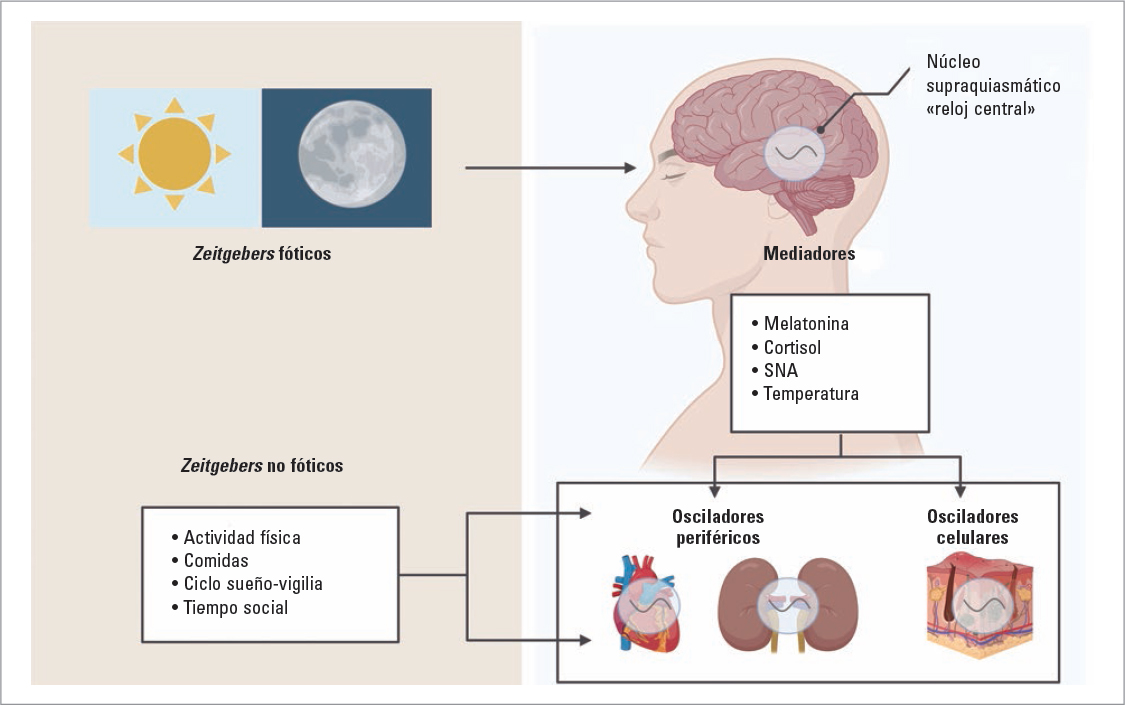
FIGURA 1. Sistema circadiano. El principal factor sincronizador es la luz diurna, que permite coordinar con el medio externo al núcleo supraquiasmático.
SNA: sistema nervioso autónomo.
Con el advenimiento de la biología molecular se descubrió que, aunque el NSQ es el generador central, esta cadencia intrínseca no se encuentra circunscrita a las neuronas del NSQ, sino que todas las células del organismo imponen su propio compás. El mecanismo de funcionamiento de estos marcapasos periféricos viene dado por ritmos de expresión génica. El funcionamiento se esquematiza en la figura 2. Durante la noche, los factores de transcripción BMAL1 y CLOCK se unen a secuencias inductoras de genes reloj, conocidos como PER y CRY. La expresión de PER y CRY aumenta a lo largo de la noche, incrementando su concentración plasmática. Hacia el final de la noche, el exceso de proteína PER y CRY tiende a hacer que se formen dímeros, trasladándose al núcleo y desacoplando los factores de transcripción BMAL y CLOCK, lo que detiene la síntesis de PER y CRY.
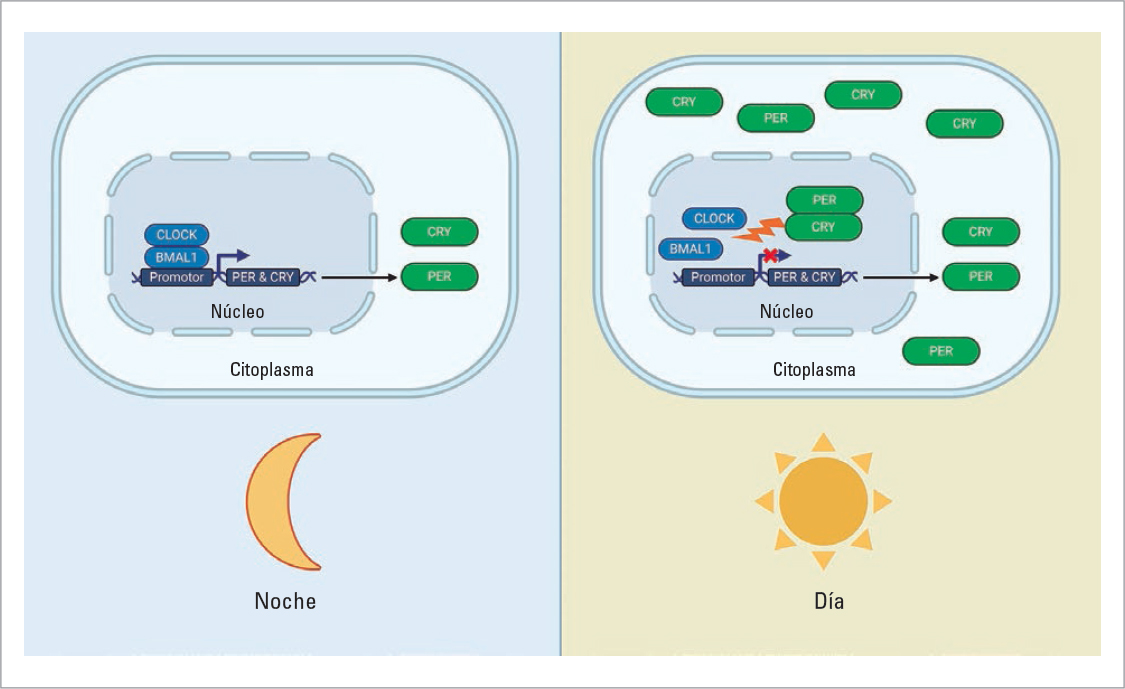
FIGURA 2. Regulación del reloj molecular. Durante la noche existe una expresión incrementada de PER y CRY inducida por los genes CLOCK y BMAL1. En el día, el exceso de las proteínas CRY y PER impide la unión de BMAL y CLOCK a las regiones promotoras, inhibiendo la síntesis de PER y CRY.
Conforme avanza el día, la enzima caseina cinasa degrada los dímeros de PER y CRY, permitiendo que los factores BMAL y CLOCK induzcan nuevamente la síntesis de PER y CRY, iniciando así un nuevo ciclo5. La importancia de este reloj interno va más allá de la creación de ritmos acordes con el entorno, ya que BMAL1 y CLOCK también promueven la expresión de genes denominados clock-controlled genes (CCG). La expresión de estos genes varía en cada tejido, constituyendo aproximadamente un 10-30% del genoma. Una característica destacada de estos genes CCG es que su activación rítmica no ocurre de manera coordinada para todos, sino que se distribuye a lo largo de las 24 horas. Esto explicaría que genes relacionados compartan una expresión coordinada a lo largo del día.
Este sistema molecular, responsable del ciclo interno en cada célula, se ve coordinado por el marcapasos central localizado en el NSQ. Este núcleo recibe las aferencias de diferentes «dadores de tiempo» (zeitgebers por su nombre en alemán), que permiten coordinar el ritmo interno con las señales externas. Algunos de los zeitgebers conocidos son la alimentación o el ejercicio físico, aunque el principal sincronizador es la luz. Esta es captada por las células ganglionares retinianas, que estimulan las neuronas del NSQ. Las neuronas del núcleo frenan durante el día la secreción de melatonina por la glándula pineal mediante la activación del sistema simpático. Solo es durante la noche que, al cesar el impulso luminoso, la melatonina es liberada, actuando sobre los tejidos periféricos y consiguiendo de este modo regular cada uno de los relojes internos celulares al ritmo externo. En este proceso, el NSQ actúa como director de orquesta, donde los tejidos periféricos ejercen de ejecutores. Sin embargo, la melatonina no es la única sustancia mediadora, sino que también ejercen este control otras moléculas como el cortisol o los cambios en la temperatura corporal regulados por el hipotálamo.
Teniendo en cuenta estos aspectos sobre el funcionamiento del reloj interno, y entendiendo la cronoterapia como un régimen terapéutico basado en los ritmos circadianos del paciente, en líneas generales caben tres tipos de intervenciones: entrenar al sistema circadiano, ajustar los fármacos a los ritmos internos o actuar farmacológicamente sobre el reloj interno. Cada uno de estos aspectos requerirían una revisión sistemática. Sirva como ejemplo una sucinta revisión de las evidencias existentes en las subespecialidades de la neurología donde estas cuestiones están mejor estudiadas.
EPILEPSIA
Teniendo en cuenta que hasta un tercio de las epilepsias se consideran farmacorresistentes6, cualquier estrategia que pueda mejorar la eficacia contra las crisis bajo ciertas premisas de seguridad siempre es bienvenida. La adaptación de los tratamientos a la susceptibilidad de padecer crisis o a la sensibilidad a fármacos a lo largo del día pueden ser estrategias que logren optimizar la respuesta en cierto grupo de pacientes.
Aunque la preferencia matutina de las epilepsias mioclónicas juveniles7 o la existencia de crisis cercanas a la menstruación en la epilepsia catamenial8 son conocidas por todos, existen otros patrones rítmicos en las epilepsias. Por ejemplo, las crisis de origen frontal, parietal o multilobares suelen presentarse con más frecuencia durante el sueño, mientras que las crisis de origen occipital o temporal aparecen más frecuentemente durante la vigilia. Con respecto a la semiología, las crisis tónicas suelen ocurrir durante el sueño, preferentemente tras la medianoche, mientras que las crisis clónicas suelen darse durante el día9.
El conocimiento de cuándo son más frecuentes las crisis puede ayudarnos a personalizar el tratamiento. La presencia de un patrón de crisis determinado en una etiología concreta puede ayudarnos a diseñar regímenes terapéuticos estándar para un determinado grupo de enfermedades. Otra estrategia puede ser administrar los fármacos en función de la susceptibilidad del propio individuo a padecer crisis. Por ejemplo, en estudios con electrodos electroencefalográficos (EEG) subcutáneos se ha demostrado que en periodos de alta frecuencia de crisis se aprecia un aumento de puntas en el EEG10, lo que podría servir de guía para incrementar el tratamiento en aquellos periodos en los que el número de puntas fuese mayor. Además, algunos tratamientos pueden actuar sobre la causa de la fluctuación, como en el caso de las crisis catameniales, donde los anticonceptivos hormonales pueden suprimir el ciclo menstrual.
A la hora de optimizar el tratamiento, otro posible acercamiento es considerar la respuesta fluctuante al fármaco a lo largo del día. Existen variaciones farmacocinéticas durante el día que afectan a la absorción, distribución y metabolización del fármaco. A lo largo del día, factores modificadores de la absorción como el pH gástrico o el vaciamiento intestinal varían. Otros factores que pueden afectar a la concentración del fármaco son variaciones en las proteínas transportadoras o cambios en la capacidad metabolizadora hepática. Estos factores han demostrado influir en las concentraciones del fármaco, por ejemplo, en el ácido valproico y la carbamazepina, cuyos niveles pueden verse reducidos tras su toma con las comidas debido a retrasos en la absorción. Además, la variación en los niveles de proteínas plasmáticas hace que las concentraciones de estos dos fármacos sean máximas en torno a las 4-6 de la madrugada. Esto tiene implicaciones terapéuticas, pudiéndose ajustar estos parámetros para conseguir una mayor eficacia cuando más lo deseamos. Otros aspectos, como el cronotipo, también pueden influir, ocasionando que la dosis de la mañana de un cronotipo vespertino sea equivalente a la dosis de la tarde de un cronotipo matutino11. Incluso el mecanismo de acción de los fármacos puede sufrir cambios circadianos, como demuestra la presencia de fluctuaciones en la diana molecular de la gabapentina12.
Sin embargo, y a pesar de la ausencia de interés de la literatura científica por el tema, la evidencia en ensayos clínicos parece corroborar la eficacia de las estrategias cronoterapéuticas. En un ensayo no controlado con 17 pacientes con crisis matutinas, acumular casi toda la dosis diaria en la noche consiguió que 11 de 17 pacientes quedaran libres de crisis13. En otro ensayo, llevado a cabo en pacientes con crisis exclusivamente diurnas que recibían fenitoína y carbamazepina y se encontraban en rango tóxico del fármaco, o que presentaban dosis infraterapéuticas, la administración de la dosis total a las 8:00 de la mañana consiguió una mejoría en el control de crisis en el grupo infraterapéutico, y una reducción de la concentración en el grupo con dosis tóxicas14. Pese a estos datos, la evidencia sigue siendo escasa y sería de utilidad disponer de estudios que pudieran demostrar la efectividad de la cronoterapia.
ENFERMEDAD DE PARKINSON
Aunque hablar de enfermedades neurodegenerativas sería muy amplio, cabe centrarse en las alteraciones del ritmo circadiano existentes en la enfermedad de Parkinson (EP) y la enfermedad de Alzheimer (EA), al ser los ejemplos más representativos de este grupo de enfermedades.
Las evidencias sobre la disrupción del sistema circadiano en la EP proceden de datos funcionales y anatómicos. Por un lado, se sabe que, comparado con controles ajustados por edad, los pacientes con EP presentan una reducción de las células ganglionares retinianas15. Si se tiene en cuenta que estas células constituyen el punto de partida de la vía aferente del sistema circadiano, se comprende cómo estos cambios contribuyen a un debilitamiento y desajuste de los ritmos circadianos, descrito en estadios precoces y tardíos de la enfermedad16. Por otro lado, los datos de afectación de las estructuras centrales del sistema circadiano son menos consistentes. Se ha descrito la presencia de cuerpos de Lewy en el NSQ en 9 de 13 enfermos con EP avanzada y en la glándula pineal en 2 de 1717.
Estas evidencias anatómicas podrían ser la base de las alteraciones funcionales que se aprecian en la enfermedad. Los pacientes presentan reducción en la amplitud del ritmo sueño-vigilia18, inversión del dipping fisiológico nocturno de tensión arterial19, aplanamiento del ritmo de cortisol20, desregulación del ritmo de melatonina21–23 y alteración de la expresión de los genes reloj24,25. Además, se sabe que el desempeño cognitivo de los pacientes con EP está relacionado con la estabilidad del ciclo sueño-vigilia y no con la propia eficiencia del sueño26.
Dada la interrelación del sistema circadiano y la EP se han probado tratamientos orientados a mejorar el ritmo circadiano de estos pacientes. Tales tratamientos, visto el papel de sistema circadiano en la EP como víctima, más que como verdugo, se basan en tratar el síntoma. Por ejemplo, dada la degeneración de las células ganglionares, junto con el sedentarismo y la menor exposición a luz solar, se ha probado el uso de dos tipos de sincronizadores: la luz y la actividad física. En los estudios que usan la luz como sincronizador se ha empleado una iluminación con pulsos de luz de unos 15-30 minutos de luz brillante de 1.000-10.000 lúmenes de intensidad, usando como placebo una iluminación con solo 300 lúmenes. Estas terapias han demostrado mejoría en la consolidación del sueño, reducción de la somnolencia diurna y mejoría en el estado de ánimo y en los síntomas motores27–32, aunque en ocasiones la eficacia se ve reducida por el bajo cumplimiento terapéutico. Respecto a la actividad física, en un estudio se demostró su eficacia a la hora de mejorar el sueño33. Los estudios con melatonina en la EP se han enfocado en su capacidad para mejorar la calidad del sueño34,35, aunque recientemente se ha publicado que el uso de 25 mg de melatonina al mediodía y tres horas antes de acostarse mejoraba la expresión de los genes reloj36.
ENFERMEDAD DE ALZHEIMER
Los pacientes con EA muestran frecuentemente alteraciones en los ritmos circadianos37. Es más, se piensa que los cambios del sistema circadiano tienen una relación bidireccional con la neurodegeneración en la EA. El efecto de la enfermedad sobre los ciclos es similar al que ocurre con el envejecimiento normal, aunque acentuado en su gravedad. Los ciclos sueño-vigilia y los ritmos de la temperatura corporal se alteran en las diferentes fases de la enfermedad, mostrando fragmentación del ciclo en fases prodrómicas38, adelantamiento de fase en pacientes con deterioro cognitivo leve39 y retraso de fase en la enfermedad establecida40. Estos cambios llevan asociados una reducción en los niveles de melatonina en la glándula pineal y en sangre periférica41, así como una alteración en la expresión de los genes reloj42, si bien dichas alteraciones neurohormonales solo se manifiestan en fases clínicas de la enfermedad. A nivel neuroanatómico se ha observado reducción en el número de neuronas y depósitos de ovillos neurofibrilares en el NSQ43, así como reducción de las células ganglionares retinianas44.
Junto a la evidencia de que la EA conduce a alteraciones circadianas, algunos estudios parecen apuntar a la disfunción circadiana como factor de riesgo para el desarrollo de EA. Además de proporcionar un biomarcador potencial de la enfermedad, la presencia de alteraciones del ritmo circadiano en la EA preclínica también sugiere que la desregulación circadiana juega un papel en la patogénesis de la enfermedad. Esta hipótesis está respaldada por varios aspectos. Diversos estudios han identificado efectos del ciclo sueño-vigilia en las dinámicas de depósito de amiloide y fosforilación de tau45, efectos neuroprotectores de la melatonina46 y un mayor riesgo de demencia en trabajadores por turnos e individuos con disfunción circadiana47,48.
Respecto al tratamiento, cada vez hay más pruebas que respaldan el beneficio potencial de la melatonina, la fototerapia y otras intervenciones para mejorar los síntomas circadianos, del sueño y los síntomas neuropsiquiátricos de la EA. En concreto, el uso de la luz en la EA se ha asociado con una mejoría de la duración y la calidad del sueño49, los síntomas depresivos, la capacidad de alerta y la agitación50. Los datos sobre melatonina no son tan prometedores por el momento, y su uso no parece reducir la incidencia de delirio postoperatorio en pacientes con deterioro cognitivo51,52.
CEFALEAS
Las cefaleas son, posiblemente, el grupo de enfermedades con una conexión más cercana con los ritmos circadianos. Tanto la cefalea en racimos como la cefalea hípnica y en menor medida la migraña tienen conexión con los ritmos circadianos. Este vínculo es especialmente patente en la cefalea en racimos, donde los pacientes presentan crisis siguiendo patrones circadianos y circanuales53. En un estudio con 1.132 pacientes se objetivó que en el 82% de los casos, los episodios de cefalea ocurrían en el mismo momento del día de forma habitual, siendo la franja horaria y las estaciones del año más frecuentes hacia las 2 a.m. y primavera y otoño54. Además, diversos estudios han demostrado cambios a nivel molecular y neuroanatómico, como reducción en los niveles y la amplitud de los ritmos de melatonina55, alteración en la expresión de genes reloj56 y aumento del metabolismo en regiones cercanas al NSQ57. Si a esto se añade que algunos de los principales desencadenantes de las crisis de dolor, como el alcohol, son también importantes disruptores circadianos58, la relación de la cefalea en racimos con el sistema circadiano no parece ser espuria.
En la cefalea hípnica y la migraña, la relación con los ritmos circadianos parece menos consolidada. Aunque la cefalea hípnica sí que presenta un claro patrón de preferencia horaria (en torno a la 1-3 a.m.), no hay evidencia de asociaciones con alteraciones moleculares59. En la migraña parece existir un aumento de los episodios en la mañana y al mediodía60, y existe una reducción de los niveles de melatonina en los días en que ocurren los episodios61. Además, en los pacientes con migraña crónica existe una plétora de cambios en los ritmos de melatonina, que van desde la reducción nocturna hasta el retraso del pico nocturno de esta hormona55.
Algunos estudios respaldan el uso de melatonina como tratamiento preventivo en la migraña62, la cefalea en racimos63 y, con datos menos consistentes, en la cefalea hípnica64.
ENFERMEDAD CEREBROVASCULAR
Cualquiera que haya tenido la fortuna de hacer guardias de neurología, habrá podido percibir los cambios en la afluencia de pacientes con ictus a la urgencia a lo largo del día. Este fenómeno ha sido estudiado de forma extensa, existiendo un metaanálisis, con más de 11.800 pacientes, que demostró que los ictus eran detectados mayoritariamente en la franja horaria matutina (el 37% ocurrían entre las 6 a.m. y las 12 del mediodía), siendo este pico principalmente debido a los ictus isquémicos de cualquier etiología65. En los ictus hemorrágicos también parece existir un pico matutino, si bien se detecta la presencia de otro aumento en horario de tarde. Este pico matutino en la incidencia de ictus isquémicos y hemorrágicos puede atribuirse a que muchos de los pacientes son encontrados en horario de mañana aunque el ictus haya ocurrido en mitad de la noche, engrosando así la cifra de ictus del despertar, que suponen casi un 30% del total de ictus. No obstante, estudios que excluyen a los pacientes de inicio incierto66 muestran también un patrón de preferencia matutina. Otras enfermedades con fisiopatología común, como el infarto de miocardio, presentan un patrón circadiano similar.
Estas diferencias en la presentación de los ictus cabe atribuirlas a cambios en la fisiología del sistema vascular, que muestra un aumento durante el día de los factores protrombóticos67, la tensión arterial68, la frecuencia cardiaca y la respuesta inflamatoria69. Dadas las variaciones circadianas, es posible plantear enfoques cronoterapéuticos que tengan en cuenta los cambios diurnos antes mencionados. Así, se sabe que la administración de fármacos antihipertensivos durante la noche mejora el perfil de control tensional durante todo el día en comparación con la administración matutina70. También, la administración de aspirina en horario nocturno consigue reducir mucho más la reactividad plaquetaria matutina, pudiendo actuar cuando más se necesita frenar la actividad de los plaquetas71.
Si todo lo comentado hasta aquí no fuera suficiente como para desear una vida con ritmos de sueño-vigilia estables, el ictus supone la confirmación de estos hechos. Además, está bien establecido que lo ritmos circadianos erráticos (como los inducidos por jet lag, trabajo a turnos o guardias) son un claro factor de riesgo vascular al incrementar el colesterol vinculado a lipoproteínas de baja densidad, la tensión arterial y la resistencia a la insulina, lo que conlleva que las personas que sufren estos ritmos caóticos padezcan más ictus que la población general72.
ESCLEROSIS MÚLTIPLE
El papel de los ritmos circadianos en la esclerosis múltiple (EM) está menos claro. Aunque la presencia de fluctuaciones circadianas en el sistema inmunitario es un fenómeno bien estudiado, no existe excesiva información en las enfermedades neuroinmunes73.
Diversos estudios han evaluado las variaciones diurnas de los síntomas de la EM. En particular, la fatiga y el dolor aumentan, mientras que la fuerza y el rendimiento cognitivo se reducen a lo largo del día. Estos cambios muestran los ritmos de fatiga preexistentes en el humano sano y no parecen corresponderse con una disrupción diferencial de los ritmos circadianos. Sin embargo, en pacientes con EM los niveles de melatonina sí que parecen disminuir y su ritmo abolirse, fenómenos que se relacionan con una mayor duración de la enfermedad, mayor discapacidad, mayor fatiga y mayor disrupción del sueño74.
Respecto a los ensayos cronoterapéuticos, son escasos. Se sabe que el efecto de los corticosteroides como tratamiento del brote es diferente en función de la hora de administración, pues la administración nocturna consigue una recuperación sintomática precoz y una mayor reducción de los mediadores inmunológicos de la enfermedad75,76. La administración de melatonina solo ha demostrado efectos antioxidantes e inductores del sueño en estos pacientes, sin haberse realizado ensayos que aborden síntomas específicos de la enfermedad77.
CONCLUSIÓN
El sistema circadiano se afecta en muchas enfermedades neurológicas e, incluso, en algunas de ellas su disrupción podría desempeñar un papel en su desarrollo e historia natural. Los tratamientos focalizados en diversos elementos del sistema circadiano, así como los tratamientos coordinados según este, pueden ser de utilidad clínica. Sin embargo, los estudios al respecto son escasos, abriéndose un interesante campo de investigación en neurología. En esta revisión narrativa se ha resumido lo principal acerca del tema tratado. Se invita al lector a profundizar, según su foco de interés, en alguna de las detalladas revisiones publicadas hasta el momento78,79.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
CONFLICTO DE INTERESES
El autor no comunica conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
El autor declara que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
El autor declara que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
El autor declara que en este trabajo no aparecen datos de pacientes.
Uso de inteligencia artificial generativa
El autor declara que no ha utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni en la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.