INTRODUCCIÓN
El uso de antidepresivos está muy extendido en neurología, algo que no resulta sorprendente si se tiene en cuenta la estrecha relación entre las enfermedades y trastornos psiquiátricos y neurológicos. De hecho, la depresión se encuentra con frecuencia vinculada a múltiples enfermedades neurológicas. Sin embargo, no abundan los estudios de calidad que definan su eficacia en las diferentes indicaciones de uso en la práctica diaria neurológica, lo que conlleva que, en muchas ocasiones, el neurólogo base su elección en su experiencia clínica.
Con frecuencia, el empleo de antidepresivos por parte de los neurólogos suele limitarse al tratamiento específico de la depresión. Sin embargo su utilidad puede extenderse más allá y tiene interés en las propias enfermedades de base, cuyo curso y pronóstico pueden mejorar con el tratamiento antidepresivo. Todo ello puede contribuir a una mejora de la capacidad funcional de los pacientes, su autopercepción y autoeficacia, de tal forma que su calidad de vida puede verse beneficiada del empleo de este tipo de fármacos.
Esta revisión tiene como objetivo analizar el uso de antidepresivos en algunas de las enfermedades más prevalentes en neurología y que conllevan repercusiones discapacitantes en quienes las padecen. De manera concreta, se analiza el uso de antidepresivos en la enfermedad de Parkinson (EP), la esclerosis múltiple (EM), la depresión postictus (DPI) y la prevención de la migraña (Tabla 1). Por otra parte, los beneficios de los antidepresivos en el deterioro cognitivo y la enfermedad de Alzheimer pueden consultarse en una reciente revisión de esta revista24.
TABLA 1. Principales estudios y ensayos clínicos de fármacos antidepresivos en migraña, enfermedad de Parkinson, esclerosis múltiple y depresión postictus
| Grupo | Antidepresivos | Dosis (mg/día) | Patología | Estudio | Resultados |
|---|---|---|---|---|---|
| ISRS | Citalopram Escitalopram Paroxetina Sertralina Fluoxetina | 10-40 10-20 20-50 50-200 20-60 | Migraña Esclerosis múltiple Enfermedad de Parkinson Depresión postictus | Banzi et al. 20151 Mitsonis et al. 20092 Ehde et al. 20083 Patten, 20094 Bomasang-Layno et al. 20155 Agüera-Ortiz et al. 20216 Paolucci et al. 20137 Dennis et al. 20198 Lundström et al. 20209 Richter et al. 202110 |
En general, tendencia a mayor eficacia que placebo en el tratamiento de la depresión asociada a las enfermedades estudiadas |
| IRSN | Venlafaxina Duloxetina | 75-150 30-90 | Migraña Esclerosis múltiple | Banzi et al. 20151 Bulut et al. 200411 Vollmer et al. 201412 Aiyer et al. 201713 Di Rezze et al. 201214 |
Eficacia superior a placebo en la prevención de la migraña Tendencia a mayor eficacia que placebo en el tratamiento de la depresión asociada a la esclerosis múltiple |
| IRNA | Atomoxetina | 40-80 | Enfermedad de Parkinson | Weintraub et al. 200315 | Sin diferencia con placebo |
| IRDN | Bupropión | 150-300 | Esclerosis múltiple Enfermedad de Parkinson | Siniscalchi et al. 201016 Solaro et al. 201817 Agüera-Ortiz et al. 20216 |
Mejoría de la apatía y la anhedonia |
| Tricíclicos | Nortriptilina Amitriptilina | 10-75 10-150 | Migraña Enfermedad de Parkinson | Silberstein et al. 201218 Jackson et al. 201519 Bomasang-Layno et al. 20155 Dobkin et al. 201120 |
Eficacia superior a placebo en la prevención de la migraña |
| Tetracíclicos | Mirtazapina | 15-45 | Enfermedad de Parkinson | Dobkin et al. 201120 Agüera-Ortiz et al. 20216 |
Eficacia para mejorar el insomnio |
| Atípicos | Tianeptina | 12,5-37,5 | Esclerosis múltiple Enfermedad de Parkinson | De Sousa et al. 2002821 Álamo et al. 201922 Agüera-Ortiz et al. 20216 |
Eficaz para el tratamiento de la depresión asociada a ambas enfermedades |
| ISRS plus | Tradozona | 50-200 | Enfermedad de Parkinson | Agüera-Ortiz et al. 20216 | Eficacia para mejorar el insomnio |
| IMAO-B | Selegilina Rasagilina Safinamida | 5-10 1 50-100 | Enfermedad de Parkinson | Bomasang-Layno et al. 20155 Barone et al. 201523 |
Eficacia superior a placebo para la depresión asociada a la enfermedad de Parkinson |
|
ISRS: inhibidores selectivos de la recaptación de serotonina; IRSN: inhibidores de la recaptación de serotonina y noradrenalina; IRNA: inhibidores de la recaptación de noradrenalina; IRDN: inhibidores de la recaptación de dopamina y noradrenalina; IMAO-B: inhibidores de la monoaminooxidasa B. |
|||||
DEPRESIÓN POST-ICTUS
La depresión es una complicación frecuente después de sufrir un ictus, de tal forma que alrededor de un tercio de las personas que sobreviven desarrollarán depresión a lo largo del primer año posterior25,26. La mayoría de los pacientes desarrollan síntomas de depresión poco después del ictus agudo, incluyendo estado de ánimo triste, apatía, pérdida o ganancia de peso, alteraciones del sueño y del apetito, fatiga, desinterés y anhedonia26,27. Estos síntomas pueden estar asociados con el deterioro de otras funciones neurológicas tales como el aprendizaje, el funcionamiento ejecutivo y funciones motoras28,29. La discapacidad y la depresión previa al ictus son los factores predictores más consistentes de la DPI, junto con el deterioro cognitivo, la gravedad del ictus, la severidad del déficit motor, la falta de apoyo social o familiar y la ansiedad26,27.
Las revisiones sistemáticas muestran que la DPI está asociada con una calidad de vida más baja26,30, peores resultados en la recuperación y rehabilitación31 y mayor morbimortalidad32. Sin embargo, a pesar de estos datos, y aunque las guías de tratamiento enfatizan la necesidad de un reconocimiento y abordaje temprano, la DPI aún permanece infradiagnosticada e infratratada33–35.
La interacción entre la depresión y el ictus es muy compleja. La DPI es una de las consecuencias neuropsiquiátricas más frecuentes. La depresión también afecta negativamente a los resultados del ictus, con un aumento de la morbilidad, la mortalidad y una peor recuperación funcional (Fig. 1). Los antidepresivos inhibidores selectivos de la recaptación de serotonina (ISRS), comúnmente prescritos, mejoran los resultados del ictus, un efecto que puede extenderse mucho más allá de la depresión, por ejemplo, a la recuperación motora. La principal teoría biológica de la DPI es la hipótesis de las aminas biógenas. Es concebible que las lesiones isquémicas interrumpan las proyecciones que ascienden desde el mesencéfalo y el tronco encefálico, lo que reduce la biodisponibilidad de las aminas serotonina, dopamina y norepinefrina. La acetilcolina también estaría implicada35.
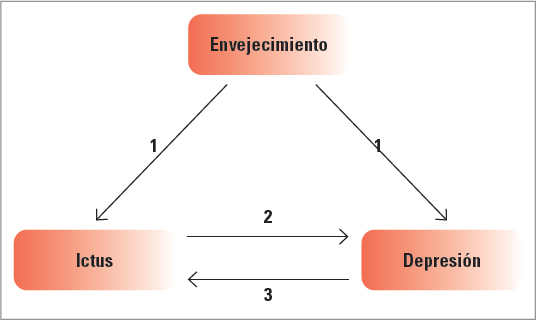
FIGURA 1. Esquema de la interacción entre ictus y depresión. 1: el envejecimiento incrementa la incidencia de ictus y depresión. 2: el ictus causa depresión. 3: la depresión incrementa los efectos negativos del ictus.
Con respecto al empleo de antidepresivos, la evidencia derivada de la práctica clínica muestra que su empleo en pacientes con DPI está lejos de un uso óptimo, detectándose que menos de la mitad de los pacientes con síntomas clínicamente relevantes de depresión están siendo tratados con antidepresivos entre uno y tres años después de haber sufrido el ictus25,36,37. De manera más concreta, solo entre el 23 y el 49% de los supervivientes a un ictus que presentaron síntomas depresivos clínicamente relevantes habían recibido tratamiento antidepresivo en los 12 meses siguientes al ictus25,36,38. En aquellos pacientes con DPI tratados con antidepresivos, los resultados de diferentes estudios muestran una asociación entre mayor severidad de la DPI y mayores tasas de uso de antidepresivos, posiblemente debido a una mayor facilidad para su detección y una mayor necesidad de tratamiento39.
De manera sorprendente, llama también la atención el hecho de que entre el 53 y el 68% de los supervivientes a un ictus recibe tratamiento antidepresivo en ausencia de sintomatología depresiva36,37,40. Este desajuste, o falta de precisión en la selección del tratamiento antidepresivo, también parece persistir más allá del primer año tras el ictus, con pruebas que demuestran que hasta cinco años después, solo entre el 22-26% de los supervivientes de ictus deprimidos declararon recibir tratamiento antidepresivo, mientras que el 59-72% de los que no padecían DPI sí lo recibieron38,41,42. Para la proporción de supervivientes de ictus no deprimidos tratados con antidepresivos, estos resultados podrían indicar que su prescripción fue efectiva y podría haberse llevado a cabo con la intención de prevenir una recaída. Alternativamente, podría sugerir que los antidepresivos fueron eficaces, pero su administración no se interrumpió después de la remisión del episodio depresivo, o que supervivientes de un ictus sin DPI pudieron haber recibido tratamiento antidepresivo sin una indicación clara.
Este desajuste en las cifras entre el uso y la necesidad de antidepresivos podría estar relacionado con el hecho de que estos, especialmente los ISRS, se usan también para facilitar otros aspectos de la recuperación posterior, como la recuperación motora junto al tratamiento de la DPI. De hecho, los resultados del ensayo FLAME43, publicado en 2011, sugirieron que la fluoxetina podría favorecer la recuperación funcional, lo que podría haber fomentado un mayor uso de los ISRS fuera de su indicación formal7. Sin embargo, otros estudios más recientes, basados en muestras más grandes, no han podido replicar este efecto8,9,44. Además, aunque un potencial uso fuera de indicación de los ISRS podría explicar un cierto sobretratamiento, ello no explicaría el actual infratratamiento con antidepresivos de la DPI, tal como la proporción de supervivientes de ictus con DPI que no reciben tratamiento con antidepresivos.
No existen guías para el tratamiento de la DPI y la efectividad de las intervenciones no ha sido bien establecida. Hasta la fecha se han utilizado, además de los ISRS, los antidepresivos tricíclicos (ADT), los inhibidores de la recaptación de serotonina y noradrenalina (IRSN) y los inhibidores de la monoaminooxidasa (IMAO).
La evidencia derivada de ensayos clínicos sugiere que los antidepresivos, especialmente los ISRS, pueden ser efectivos para tratar la DPI y reducir el riesgo de desarrollar síntomas depresivos después del ictus8,9,10. Como se ha comentado, más allá del tratamiento de la DPI en sí misma, se ha hipotetizado que los antidepresivos podrían también mejorar la recuperación funcional del ictus. En este sentido, en modelos animales de ictus los antidepresivos atenúan el crecimiento del infarto, promueven la neurogénesis y tienen efectos neuroprotectores45,46. Por su parte, resultados procedentes de las fases iniciales de investigaciones clínicas de pacientes con ictus agudos y crónicos tratados con ISRS muestran asociaciones favorables con la neuroplasticidad y la recuperación motora43,47,48. Sin embargo, los hallazgos de ensayos clínicos a mayor escala no encuentran que el tratamiento de la DPI con ISRS vaya seguido de una mejoría significativa a nivel funcional después de haber sufrido un ictus49–51.
Los resultados de una reciente revisión Cochrane que incluyó 9.168 supervivientes dentro del primer año posterior a haber sufrido un ictus hemorrágico o isquémico mostraron que de los estudios incluidos, 32 ensayos clínicos utilizaron fluoxetina, 11 paroxetina, 8 sertralina, 8 citalopram y 2 escitalopram49. La duración del tratamiento varió entre semanas y meses. Los ISRS redujeron las puntuaciones medias de depresión, pero presentaron dos veces más efectos secundarios gastrointestinales comparados con placebo. No hubo diferencias significativas en cuanto al riesgo de sufrir crisis epilépticas. Además, el empleo de ISRS no afectó a la discapacidad o la dependencia y redujo el riesgo de una futura depresión.
En cuanto a su eficacia diferencial, los diferentes estudios que comparan entre sí distintos antidepresivos no aportan datos que evidencien una superioridad de un fármaco específico frente a otro52, lo que dificulta las posibilidades de una adecuada elección. Tampoco se puede afirmar cuál es el fármaco que presenta menos efectos secundarios o por cuanto tiempo deberían ser administrados y a qué dosis49. Finalmente, no se dispone de suficientes datos para hacer recomendaciones sobre el riesgo de sangrado, algo de capital importancia en pacientes con ictus hemorrágicos que desarrollan depresión y en pacientes con ictus isquémicos a quienes se prescribe antiagregantes plaquetarios o fármacos anticoagulantes52.
ENFERMEDAD DE PARKINSON
La depresión es una manifestación frecuente en los pacientes con EP, llegando a padecerla hasta un 35-50% de todos ellos53. La depresión en la EP causa un gran impacto en la calidad de vida de los pacientes54,55 y se ha asociado a un deterioro cognitivo más rápido, mayores tasas de ansiedad, incremento de la mortalidad56 y mayor sobrecarga de los familiares y cuidadores57–59. Se sabe que la depresión puede ser un marcador clínico premotor de la EP60. Sin embargo, a pesar del profundo impacto de los síntomas depresivos en la calidad de vida y el funcionamiento cognitivo de los pacientes con EP, la depresión es a menudo no reconocida e insuficientemente tratada15,61,62. Solo un 25% de los pacientes deprimidos reciben tratamiento15 a pesar de su favorable impacto en la calidad de vida y la discapacidad en la EP63.
Por otra parte, se ha de reconocer que a pesar de la alta prevalencia de depresión en la EP y su impacto negativo sobre la funcionalidad y la calidad de vida, existe una limitada evidencia de la seguridad y eficacia de los antidepresivos en esta población de pacientes. No abundan los ensayos clínicos controlados y los informes de práctica clínica; los estudios disponibles muestran limitaciones importantes derivadas del pequeño tamaño de las muestras, la corta duración de los ensayos o la disparidad en los criterios diagnósticos de depresión utilizados64,65. Los fármacos más estudiados han sido los ISRS y los ADT. Menos frecuentes son los estudios que valoran el efecto de los IRNS, trazodona, atomoxetina o agonistas dopaminérgicos5,66.
Los antidepresivos más frecuentemente prescritos en la EP son los ISRS, seguidos de mirtazapina y ADT como nortriptilina67. Sin embargo, los ISRS a menudo se usan con precaución debido a los informes de algunos estudios preclínicos y clínicos que informaron de un empeoramiento del parkinsonismo68,69. En este sentido, los resultados de una revisión mostraron que los síntomas extrapiramidales en pacientes tratados con antidepresivos serotoninérgicos alcanzaron el 78% en sujetos menores de 65 años, siendo superior en mujeres (57%) que en hombres (43%)70. La mayor frecuencia de efectos extrapiramidales se observó con citalopram/escitalopram (22%) y la menor con sertralina (15%), si bien la función motora no se deterioró significativamente.
En cuanto a su eficacia, los resultados de dos metaanálisis de ensayos clínicos sobre la eficacia de los antidepresivos en depresión y EP mostraron evidencias a favor de la eficacia de los ISRS, los ADT y los IMAO-B5,71. Además, ninguno de ellos empeoró los síntomas motores o incrementó la probabilidad de discontinuación del tratamiento71. Otros estudios han informado de que el mayor efecto sobre los síntomas depresivos se encontró con los IMAO-B, incluidos rasagilina23 y safinamida72.
Por otra parte, entre las recomendaciones derivadas de un grupo de consenso destaca el empleo de antidepresivos también para el tratamiento de otras manifestaciones no motoras de la EP, como: bupropión para el abordaje de la apatía, mirtazapina en caso de insomnio y como orexígeno, trazodona cuando existen problemas de sueño, duloxetina si existe dolor y amitriptilina para combatir la sialorrea73.
Los estudios de comparación entre ISRS y ADT suelen mostrar similar eficacia entre ambos grupos farmacológicos74,75. Se ha argumentado, además, que las propiedades anticolinérgicas de los ADT podrían reducir también el temblor y el insomnio en estos pacientes. Sin embargo, en la actualidad los ADT se recomiendan solamente como tratamiento de segunda línea para la depresión en la EP debido a sus efectos adversos, incluyendo hipotensión ortostática, sequedad de boca, estreñimiento, retención urinaria, deterioro de la memoria, alucinaciones y confusión. Dentro de este grupo farmacológico, la nortriptilina constituiría la opción más segura dado su bajo perfil de efectos anticolinérgicos76.
En un reciente consenso de expertos, los antidepresivos ISRS, IRSN (venlafaxina, desvenlafaxina y duloxetina), vortioxetina, bupropión, mirtazapina, tianeptina y los agonistas dopaminérgicos (pramipexol, ropinirol y rotigotina) se consideraron opciones farmacológicas eficaces y bien toleradas para el tratamiento de la depresión en la EP. Dentro de los ISRS, hubo consenso en calificar a sertralina como el fármaco más seguro. Por el contrario, los ADT fueron considerados como antidepresivos no seguros debido a sus efectos secundarios y, por lo tanto, no deberían ser prescritos6.
En conclusión, los antidepresivos son fármacos, en general, seguros y bien tolerados en el tratamiento de la EP, siendo los ISRS (citalopram, escitalopram, paroxetina) y los IRSN (venlafaxina, duloxetina) los de mayor frecuencia de uso para el tratamiento de la depresión. Es necesario estar alerta ante la posible aparición de efectos extrapiramidales de los ISRS y de efectos anticolinérgicos de los ADT, como la nortriptilina.
ESCLEROSIS MÚLTIPLE
La EM es la enfermedad desmielinizante más frecuente del sistema nervioso central y en su patogénesis están implicados procesos inflamatorios, neurodegenerativos y autoinmunes77,78. La mayoría de los casos se caracterizan por un curso clínico con presencia de recaídas y remisiones, constituyendo los acontecimientos estresantes de la vida un factor significativo responsable de desencadenar dichas recaídas2,79.
Los pacientes con EM manifiestan frecuentemente síntomas de depresión y ansiedad20,80,81. De hecho, los estudios señalan un 50% de riesgo de depresión mayor a lo largo de la vida de los pacientes con EM82, llegando a hacerse presente en alrededor del 25% de ellos80,83. Esta asociación afecta de forma importante a la calidad de vida percibida por los pacientes, de tal forma que se considera que la depresión es, después de la discapacidad, el segundo factor que más afecta a su calidad de vida84.
La etiología de la depresión en la EM es probablemente multifactorial y puede incluir componentes biológicos y psicológicos. Por un lado, recibir un diagnóstico de EM puede constituir un factor de riesgo para el desarrollo de depresión derivado del hecho de ser una enfermedad crónica con un curso impredecible85. Por otra parte, el daño estructural en curso en el sistema nervioso central de los pacientes con EM puede también contribuir a la sintomatología depresiva86. Por todo ello, junto a las estrategias terapéuticas actuales, como las terapias modificadoras de la enfermedad, los antidepresivos se prescriben con frecuencia en pacientes con EM87.
Partiendo de esa premisa, los antidepresivos podrían constituir una terapia adyuvante muy prometedora para la EM, ya que una mayor disponibilidad de serotonina puede ser eficaz para revertir el impacto del estrés crónico en la progresión de la enfermedad. En el ámbito clínico, los antidepresivos han demostrado ser eficaces no solo en el abordaje de la depresión comórbida con la EM4,88, sino también para minimizar las recaídas relacionadas con el estrés, como demuestran los ensayos clínicos de escitalopram89 o paroxetina3. Otros antidepresivos como tianeptina o vortioxetina, que combinan sus propiedades antidepresivas con un efecto potenciador de la cognición22,90, constituyen una opción de tratamiento, dado que alrededor de la mitad de los pacientes con EM manifiestan deterioro cognitivo21.
Los antidepresivos tienen también la capacidad de aliviar otros síntomas presentes en la EM. Por ejemplo, el bupropión puede beneficiar a los pacientes que sufren fatiga, uno de los síntomas más frecuentes en la EM y que más afecta a la calidad de vida16,17. En relación con el dolor neuropático, presente en más del 25% de los pacientes, tanto la duloxetina12 como la venlafaxina13 han demostrado su utilidad para abordar este síntoma. En relación con el síndrome de la vejiga hiperactiva, precursor de la incontinencia urinaria, se ha observado que la duloxetina resultó eficaz para mejorar esta manifestación14.
En definitiva, la evidencia sugiere que los antidepresivos no son solo efectivos para tratar la depresión en pacientes con EM, sino que también son eficaces para aliviar otros síntomas altamente estresantes y frecuentes91. Además, los antidepresivos incluso han mostrado poder alterar el curso de la enfermedad y retrasar su progresión al frenar las recaídas relacionadas con el estrés89.
PREVENCIÓN DE LA MIGRAÑA
La migraña es un trastorno discapacitante que requiere tratamiento para los ataques agudos y con frecuencia precisa de terapia preventiva92,93. Las directrices de la American Headache Society94, entre otras sociedades, recomiendan esta última en pacientes con frecuentes ataques de migraña incapacitantes (cuatro o más días de cefalea al mes) y otros escenarios, como contraindicación, uso excesivo o acontecimientos adversos del tratamiento sintomático95. Un criterio adicional sería la preferencia del propio paciente por el tratamiento preventivo cuando la migraña altera de manera significativa la capacidad funcional y su calidad de vida. Alrededor del 40% de los pacientes con migraña son candidatos a tratamiento preventivo96, cuyo objetivo es reducir la frecuencia, duración y gravedad de los ataques, lo que, a su vez, facilitaría el control de los episodios agudos (respuesta al tratamiento sintomático).
La patogénesis de la migraña no es del todo bien conocida, habiéndose implicado alteraciones de los niveles de serotonina y sus receptores en la activación de la vía nociceptiva trigeminovascular97,98. En este sentido, la actuación sobre los receptores de serotonina regularía la respuesta vascular y limitaría la liberación de compuestos vasoactivos, como la sustancia P99.
Junto a grupos farmacológicos clásicos como los betabloqueantes, antiepilépticos neuromoduladores, bloqueantes de los canales de calcio y los actuales anticuerpos monoclonales contra el péptido relacionado con el gen de la calcitonina o su receptor, la amitriptilina y otros antidepresivos tienen indicación preventiva en la migraña o sus comorbilidades.
Los ADT fueron los primeros agentes que demostraron ser eficaces en la prevención de la migraña allá por la década de los sesenta del pasado siglo100 y han sido de los fármacos más utilizados en la prevención de la migraña101. Al mismo tiempo, los ISRS y los IRSN también se consideran como posibles opciones terapéuticas preventivas en las guías clínicas1. Su acción preventiva se atribuye principalmente a la inhibición de la recaptación de serotonina y noradrenalina y al mantenimiento de los niveles de serotonina. De hecho, los antidepresivos con un efecto farmacodinámico agonista de los receptores de 5-HT2 tienen utilidad en la profilaxis de la migraña18.
Dentro de los ADT, la amitriptilina, a dosis variables, ha sido el fármaco más estudiado y usado en la prevención de la migraña19,102. A pesar de su mayor frecuencia de uso, cuando se compara su eficacia con los ISRS y los IRSN, los resultados de varios estudios sugieren que no hay diferencia en términos de frecuencia de la migraña o tasas de respuesta11,103. De hecho, los ADT no fueron más eficaces que los ISRS para lograr una reducción del 50% de la frecuencia de migraña104. Por el contrario, los pacientes tratados con amitriptilina presentan más tendencia a abandonar el tratamiento debido a una mayor incidencia de efectos adversos que los tratados con ISRS o IRSN105. Es necesario tener también en cuenta sus posibles efectos sedantes, especialmente en personas mayores, así como la ganancia de peso y la potencial prolongación del intervalo QT106.
En la práctica clínica se recomienda empezar con una dosis baja del fármaco elegido, que puede incrementarse progresivamente en función del resultado obtenido. Una vez instaurado el tratamiento, debería mantenerse al menos durante tres meses y, generalmente, entre seis y doce meses, antes de proceder a su retirada gradual y progresiva.
CONCLUSIONES
Pese a estar muy extendido, el uso de antidepresivos en neurología es un campo carente aún de una evidencia científica sólida que aclare su papel en el tratamiento de algunas de las enfermedades más frecuentes en la práctica clínica. Sin embargo, los consensos de expertos y la evidencia derivada de su empleo en un entorno real muestran que muchos problemas neurológicos se benefician de un tratamiento antidepresivo, no solo en lo que concierne a la mejoría de los síntomas depresivos acompañantes, sino también por su efecto positivo en la capacidad funcional de los pacientes. Debería promoverse el desarrollo de ensayos clínicos bien diseñados que confirmen las principales indicaciones de los fármacos antidepresivos en neurología.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
CONFLICTO DE INTERESES
El autor no comunica conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
El autor declara que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
El autor declara que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
El autor declara que en este trabajo no aparecen datos de pacientes.
Uso de inteligencia artificial generativa
El autor autor declara que no ha utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.