INTRODUCCIÓN
Los trastornos del movimiento (TM) son un grupo heterogéneo de enfermedades muy frecuentes en las consultas de neurología, siendo la enfermedad de Parkinson (EP) la más representativa. Como muchas otras enfermedades neurológicas, la imposibilidad de acceder al cerebro directamente y la complejidad en la expresión clínica hacen que tengamos que basarnos en datos de la anamnesis, la exploración y las pruebas complementarias para su correcto manejo.
A pesar de que este aspecto semiológico es una de las grandes bellezas de esta disciplina, la subjetividad que lleva implícita es una de las limitaciones actuales para el correcto manejo y adecuado tratamiento de los pacientes afectados por TM.
Las novedosas técnicas de análisis de datos, englobadas dentro de la inteligencia artificial (IA), junto con el uso de sensores, se están postulando como una buena solución a este problema. Aunque muchas de las técnicas ya llevan años entre nosotros (la concepción teórica de las redes neuronales data de 19431), la reducción de los costes y el aumento de la potencia de los ordenadores personales y de los servidores están permitiendo su aplicación masiva. Estos avances tecnológicos también tienen impacto en otros ámbitos del manejo de los TM, como son la neuroimagen, la genética y el desarrollo de nuevos fármacos, permitiendo cada vez el análisis de mayor cantidad de información.
Entre todas las ramas de la IA2 merece mención especial, por su gran uso actual y buen rendimiento, el aprendizaje profundo (deep learning), un subtipo de IA en el cual el modelo hace aprendizaje automático con abstracciones de alto nivel. Esto significa que es capaz de identificar relaciones y patrones complejos en los datos, lo que le hace especialmente útil para analizar gran cantidad de información con múltiples variables. En general, este tipo de aprendizaje permite hacer predicciones evitando los sesgos y las limitaciones que tendríamos con los modelos clásicos, como pueden ser el uso de pesos fijos para cada variable o el uso de puntos de corte.
Existen numerosas técnicas de IA3 que pueden aplicarse en investigación biomédica o en el proceso asistencial en función del problema que estemos tratando de solucionar, cada una con sus propias limitaciones. Esta revisión aborda algunos ejemplos relevantes de la aplicación clínica de las técnicas más novedosas y avanzadas de IA cuya comprensión y utilización son de interés para el neurólogo general o especializado en esta área.
ANÁLISIS DE SENSORES Y SEÑALES
En los TM tenemos la gran ventaja de que la exploración se basa en el movimiento, valga la redundancia, y esta información es relativamente fácil de digitalizar mediante el uso de sensores inerciales.
Este tipo de sensores, que son capaces de medir la posición y la aceleración en los distintos planos del espacio, han permitido el desarrollo de wearables o dispositivos vestibles que puede llevar el paciente para realizar una monitorización continua4. Estos sensores también están disponible en la mayoría de los smartphones, por lo que algunos trabajos se han basado en su uso dada la ubicuidad de estos5.
Los estudios se han centrado en valorar diferentes manifestaciones de los TM, como el temblor6–9, la bradicinesia10, las discinesias11, la «congelación» al caminar12 o la inestabilidad13. Se dispone también de estudios enfocados al diagnóstico precoz14 y a la discriminación de los diferentes tipos de parkinsonismos15, entre otros usos.
En el caso de otros TM, como los trastornos hipercinéticos, se han usado dispositivos que además de incorporar sensores inerciales permiten la medición del electromiograma de superficie16 u otro tipo de señales17.
Una de las desventajas de estas aplicaciones es la necesidad de usar dispositivos externos para la recogida de los datos. Esto se ha podido solucionar en parte con el uso de dispositivos móviles9,18 o con dispositivos comerciales como el Apple Watch19, entre otros, desarrollados para ese fin20, lo que facilita enormemente la tarea y están empezando a trasladarse a la clínica21.
La principal utilidad de estas iniciativas es realizar una monitorización continua en el domicilio, intentar mejorar los resultados de los diarios y evitar el efecto Hawthorne (rendir mejor durante la exploración al sentirse observados) que se produce en la consulta22.
Los resultados de este tipo de estudios son variables en función de lo que se pretenda medir. En general, para síntomas y signos aislados se obtienen buenos resultados, con precisiones por encima del 90% en muchos estudios10–12. También se pueden determinar diferentes manifestaciones motoras de forma conjunta, pero en la mayoría de los casos se requieren múltiples sensores, cuestión que limita su uso y la comodidad para el paciente20.
La prueba de la utilidad de esta aproximación a la monitorización y la evaluación de los TM es que ya existen dispositivos comerciales que permiten su uso en la clínica. Algunos de estos dispositivos, como Global Kinetics23, están ideados para ser llevados en la muñeca por el paciente, mientras que otros hacen uso de la API (interfaz de programación de aplicaciones) desarrollada por Apple para su Apple Watch, como Parki app24. En otros casos la aproximación es diferente y se basan en un dispositivo que se lleva en la cintura, como STAT-ON25 (Tabla 1). Conforme vaya aumentando la disponibilidad de las aplicaciones y los dispositivos, este tipo de mediciones van a ser fundamentales para la valoración y sobre todo para la monitorización de los pacientes con TM.
TABLA 1. Comparación de las principales soluciones de monitorización actualmente comercializadas. Coste anual convertido de libras a euros según la tasa de cambio en febrero de 2023
| Kinesia 360 | PKG | PDMonitor | STAT-ON | |
|---|---|---|---|---|
| Numero de dispositivos | 1 o 2 | 1 | 2 | 1 |
| Localización | Muñeca, dedo, tobillo | Muñeca | Muñeca | Cintura |
| Coste anual por paciente | 3.030 € | 505 €* | 2.700 € | 1.800 € |
| Bradicinesia | En gráfica | En puntuación | En gráfica | No |
| Discinesias | En puntuación | En puntuación | En gráfica | En gráfica |
| Fluctuaciones | En gráfica | En puntuación | En gráfica | En gráfica |
| Temblor | En porcentaje | En porcentaje | En gráfica | No |
| Inactividad | En porcentaje | En porcentaje | En gráfica | En gráfica |
| Actividad | En porcentaje | No | En gráfica | Sí |
| Pasos | Sí | No | No | Sí |
| Distribución de síntomas a lo largo del día | Sí | No | Sí | Sí |
| Variación de los síntomas con la medicación | Sí | No | No | No |
| Congelaciones | No | No | En gráfica | En número |
| Caídas | No | No | No | En número |
| Aplicación para el paciente | No | Sí | Sí | No |
|
*Excluyendo el análisis inicial. Adaptada de Cox et al. 2022. |
||||
Por último, también se han realizado estudios de los patrones respiratorios del sueño26 y en pruebas neurofisiológicas27,28. En los primeros26 se alcanzan unas buenas sensibilidad y especificidad, en torno al 80%, en los diferentes modelos, con una correlación de 0,94 con la escala UPDRS (Unified Parkinson’s Disease Rating Scale). En los estudios electromiográficos se diferencia adecuadamente entre controles y pacientes con temblor esencial27, y entre temblor esencial y EP28, con una sensibilidad y una especificidad de más del 90% en ambos casos. Existen otros estudios que muestran resultados similares con otros métodos.
Llama la atención que, pese a estos buenos resultados, no existan dispositivos ni softwares comerciales que exploten esta posibilidad, dado que en muchas ocasiones se realizan costosas pruebas de medicina nuclear o se mantiene a los pacientes en seguimiento durante meses o años antes de obtener un diagnóstico. La explicación más probable es la dificultad para la generalización de los resultados de los modelos de IA desarrollados en trabajos de investigación con tamaños muestrales pequeños, o la escasa disponibilidad de los dispositivos que se usan en los estudios para fines traslacionales al no estar comercializados.
ANÁLISIS DE IMÁGENES
El análisis de imágenes radiológicas y de otros tipos de imágenes médicas ha sido el punto de entrada de la IA en muchas áreas29. Esto se ha visto facilitado por la disponibilidad de estas imágenes en formato digitalizado, fácilmente accesible y etiquetable3.
En el campo de los TM, este tipo de análisis se han realizado fundamentalmente en estudios de medicina nuclear30 y de resonancia magnética30,31, y con frecuencia se han usado unos modelos denominados «redes neuronales convolucionales»30. Estas redes pueden analizar datos presentados en una dimensión (por ejemplo, señales electroencefalográficas), en dos dimensiones (un corte de neuroimagen o fotografías) o en tres dimensiones (estudios de neuroimagen completos). Para ello se usan varias capas en las que la propia red aísla las características más importantes para posteriormente hacer una predicción (Fig. 1). La mayor parte de estos estudios se han realizado con el objetivo de asistir al diagnóstico30, aunque otros se han centrado en la progresión de las enfermedades32–34 o el diagnóstico precoz35,36.
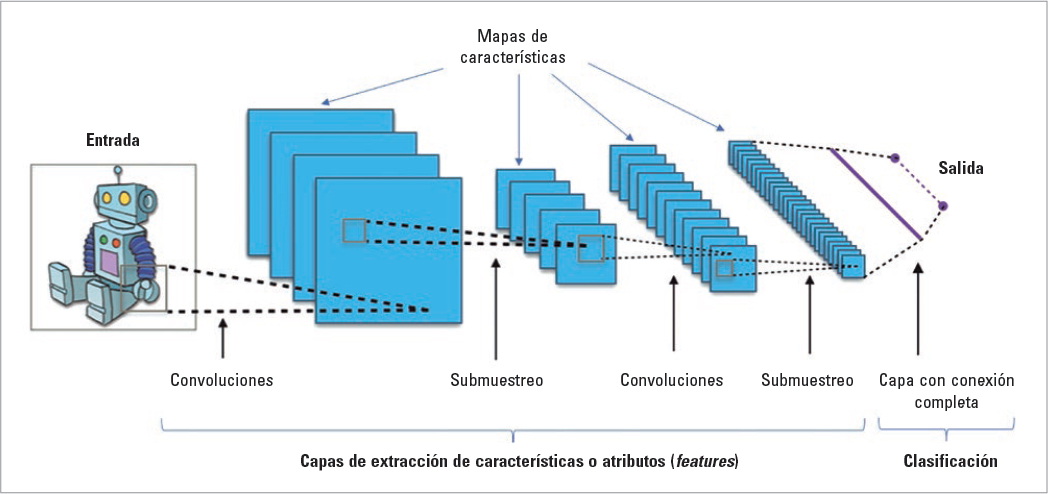
FIGURA 1. Esquema de la arquitectura de las redes neuronales convolucionales. Modificada de: Aphex34, CC BY-SA 4.0. https://creativecommons.org/licenses/by-sa/4.0, vía Wikimedia Commons.
La mayoría de los estudios realizados en resonancia magnética y medicina nuclear como asistencia al diagnóstico alcanzan una precisión superior al 80%, llegando en algunos casos al 99,6% en DaTSCAN y al 95,3% en resonancia magnética30 para el diagnóstico de EP, y al 98,8% para el diagnóstico de distonías37. Aunque tales resultados puedan parecer muy prometedores, y en ocasiones hayan sido capaces de clasificar mejor que los especialistas en radiología o en medicina nuclear, hay que tener en cuenta que muchos de estos estudios se han llevado a cabo comparando pacientes y controles sanos (la mejor situación posible), perdiendo así validez externa al analizar casos más dudosos, como ocurre en la práctica clínica habitual.
Esta pérdida de validez se ha intentado resolver en otros estudios que han pretendido distinguir entre parkinsonismos38, o entre demencia con cuerpos de Lewy y demencia por enfermedad de Alzheimer39, obteniendo una precisión del 85,2% y del 79,2%, respectivamente. Si bien son resultados muy buenos, resultan menos espectaculares que en los estudios realizados frente a controles sanos. Este segundo grupo de estudios es quizás el que mejor refleja la situación actual y nos explica por qué, pese a disponer de resultados muy prometedores en numerosos estudios, su aplicación clínica no se ha generalizado.
La progresión se ha estudiado con DaTSCAN, resonancia magnética y las escalas UPDRS (Unified Parkinson’s Disease Rating Scale)33,34, Hoehn y Yahr32, y MDS (International Parkinson and Movement Disorder Society)-UPDRS40. En todos estos casos, para predecir la progresión de la enfermedad no solo se han usado datos de las imágenes, sino que se han añadido a los modelos otras variables clínicas, como la escala MDS-UPDRS-III. La precisión de estos modelos es modesta, entre un 75 y un 80%34,40 o un área bajo la curva (AUC) de 0,8432, teniendo la escala MDS-UPDRS-III un mayor peso en la predicción que las propias imágenes. El uso de las pruebas de imagen en estos modelos parece mejorar su rendimiento, pero la imagen aislada no es suficiente para predecir la progresión. En otras palabras, la utilidad de las imágenes para predecir la progresión de los TM es, al menos por ahora, limitada.
Otra de las utilidades es la posibilidad de realizar un diagnóstico precoz en este tipo de enfermedades. La enfermedad de Huntington36,41 es ideal para este objetivo, dado que en los estudios familiares pueden obtenerse numerosos pacientes preclínicos. En un estudio41 se valoró la posibilidad de utilizar técnicas de machine learning, pero finalmente se usó una regresión logística al obtener un mejor resultado. En cambio, en otro estudio36, pese a ser más antiguo, se utilizó support vector machine, una técnica que puede considerarse machine learning para clasificación, obteniendo una precisión del 71%. También se ha realizado una aproximación similar para el diagnóstico precoz de la EP; en este caso se obtuvo un AUC de 0,97 usando, además de las imágenes, datos clínicos35.
Igualmente, este tipo de estrategias se ha utilizado en estudios con imágenes no radiológicas. Del mismo modo que en las iniciativas anteriores, se ha intentado realizar un diagnóstico precoz de la EP, pero esta vez mediante el análisis de la escritura y fundamentalmente de espirales42–46. Algunos de estos estudios han comunicado precisiones elevadas, entre el 80,8%47 y el 96,8%48. En estas tareas, las redes neuronales parecen arrojar unos resultados discretamente superiores. Además, a pesar de usar controles sanos, parecen ser capaces de diagnosticar mejor que los estudios basados en neuroimagen. Esto puede guardar relación con dos diferencias en los datos que se analizan: la complejidad, que es menor en el caso del análisis de los trazos, y una selección de los datos más adecuada, ya que se están midiendo alteraciones ya conocidas en estas enfermedades en lugar de buscar patrones nuevos.
Los resultados aquí mencionados y la disponibilidad para su análisis hacen pensar que esta línea de trabajo seguirá desarrollándose en los próximos años, siendo probable que en poco tiempo podamos ver aplicaciones reales en el día a día.
ANÁLISIS DE VÍDEO
El análisis de vídeo en los TM se fundamenta en una combinación entre los dos métodos anteriores (sensores e imágenes), pues permite analizar la posición y el movimiento de las distintas partes del cuerpo mediante el uso de imágenes repetidas.
El desarrollo de estas técnicas se ha visto limitado por la dificultad de determinar de manera fiable la posición de las articulaciones en el espacio, también llamada «estimación de pose» (pose stimation). En un inicio, para realizar esta tarea se han usado diferentes modelos matemáticos49,50, sistemas referenciales51 y sistemas con varias cámaras, como Microsoft Kinect52. En los últimos años se han desarrollado técnicas que permiten realizar un esqueleto tridimensional mediante una sola imagen bidimensional53,54, lo que ha mejorado mucho la fiabilidad de estos sistemas (Fig. 2).
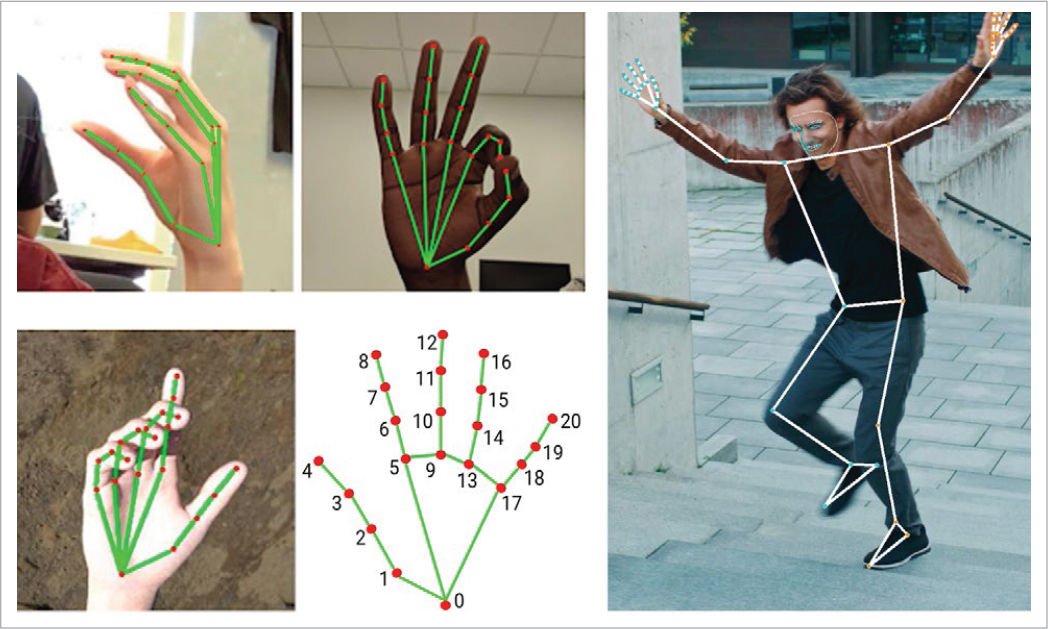
FIGURA 2. Estimación de pose para las manos y para el cuerpo entero. Modificada y adaptada de: https://developers.google.com/mediapipe.
Se dispone de estudios con estas técnicas más modernas que han estimado la validez de sus mediciones55 y su capacidad de correlacionar los parámetros medidos con las valoraciones clínicas de los pacientes en cuanto a la marcha55,56, la bradicinesia57–59 y el temblor60–62.
La medición de la marcha con una sola cámara tiene como principal dificultad la correcta medición de la profundidad. A pesar de ello, existen estudios55 que demuestran que es factible la medición de forma precisa de la velocidad, la amplitud, el braceo y otras características de la marcha. La extracción de estas características de la marcha permite la diferenciación de los pacientes con EP, con una buena correlación con la MDS-UPDRS-III55 incluso en aquellos en estadios iniciales de la enfermedad56.
La evaluación de la bradicinesia ha dado resultados más variables, consiguiendo clasificar correctamente a los pacientes en algunos estudios58, con AUC de hasta 1 según la tarea evaluada, pero con peor capacidad para estimar los ítems de bradicinesia de la MDS-UPDRS III de forma automática59, con índices de correlación intraclase de hasta 0,31 en pacientes en on y de 0,84 en pacientes en off. Otros estudios han tenido más éxito en la estimación de los ítems de bradicinesia de la MDS-UPDRS III, extrayendo características con IA y analizándolas con modelos más clásicos57.
En cuanto al temblor, se han desarrollado algoritmos que detectan el temblor de manera relativamente fiable, con una precisión de 0,8262, y otros que realizan una estimación de los ítems de temblor de la MDS-UPDRS III con una precisión entre 0,85 y 0,9761. La mayor precisión de estos modelos puede estar relacionada con la utilización de una menor cantidad de características en el análisis al estimar el valor más que por el modelo en sí mismo. Al igual que con las manos, se ha podido correlacionar la gravedad del temblor cefálico, medida por la escala TOTHEADTREM, con su velocidad angular60.
El uso de esqueletos para la extracción de los datos de movimiento es relativamente reciente y, aunque es prometedor, todavía quedan cuestiones por resolver. En primer lugar, la falta de homogeneidad de los datos, las diferentes condiciones y aparatos de grabación, así como la necesidad de normalizar los datos, con frecuencia limitan la generalización de los resultados. Por otra parte, la precisión de la medición, sobre todo en los movimientos de las manos, puede ser un factor limitante que además explique en parte por qué los estudios más enfocados en la bradicinesia han obtenido peores resultados.
A pesar de estas limitaciones, es probable que veamos un gran aumento de estos estudios en los próximos años, dada la facilidad de obtener imágenes de vídeo sin necesitar complejos aparatos de medición inercial.
ANÁLISIS DE VOZ
Las alteraciones de la voz están presentes en muchos TM. Su relativa simplicidad ha permitido realizar estudios de señales desde hace tiempo, pero solo el reciente desarrollo y la disponibilidad de redes neuronales diseñadas para datos en serie, como las redes convolucionales LSTM (Long Short-Term Memory), han permitido aumentar el rendimiento de su análisis con IA.
En la EP se han realizado estudios enfocados al diagnóstico precoz63, con un AUC por encima de 0,85, y para detectar la respuesta a la medicación64 con una precisión entre 0,73 y 0,83.
También se ha realizado análisis espectral de la voz en el temblor esencial64, permitiendo clasificar correctamente controles sanos y pacientes, incluso aquellos sin temblor aparente.
Las aproximaciones al diagnóstico o a la evaluación de los TM mediante la voz muestran muy buenos resultados y son fácilmente implementables, pero ignoran muchas características motoras de estos pacientes que, en la práctica clínica diaria, son más útiles para la toma de decisiones. Es necesario que estos modelos se integren en otros más complejos para que la valoración de los pacientes con estas herramientas sea integral.
ANÁLISIS DE LOS MOVIMIENTOS OCULARES
Los movimientos oculares también se han estudiado mediante IA en diversas enfermedades, incluyendo algunas degenerativas como la enfermedad de Alzheimer y la EP65.
Los resultados al clasificar los pacientes varían en función de las mediciones realizadas. Se han publicado datos de precisión tan bajos como 0,57 para las sacadas y las antisacadas66, pero los números mejoran cuando se evalúa el seguimiento, con precisiones de 0,74-0,7767,68.
En otras enfermedades, como la de Huntington, se han realizado estudios similares69 con resultados parecidos a los previos en cuanto a diferenciar pacientes presintomáticos (precisión del 73,4%) y separar pacientes presintomáticos de sintomáticos (precisión del 83,5%).
Pese a que las alteraciones en los movimientos oculares están presentes en muchas enfermedades neurodegenerativas70, en este ámbito se ha avanzado menos, lo que probablemente se debe a que los instrumentos necesarios no están disponibles de forma generalizada en el ámbito asistencial.
CONCLUSIONES
En la actualidad se dispone de varias soluciones comerciales que pueden ser de ayuda en la valoración y el seguimiento de los pacientes con EP y otros TM, facilitando la labor y la calidad asistencial. Es previsible que en los próximos años aumente el número de estos dispositivos a medida que se vayan resolviendo sus principales escollos. El primero, y a nuestro parecer uno de los más importantes, es lograr la simplificación de su uso y la integración en los modelos asistenciales habituales. Un ejemplo práctico de esto, aunque aplicado a otro ámbito, es la tecnología RAPID71 en la evaluación de las pruebas de imagen en el ictus isquémico agudo, lo que contrasta con la mayoría de los dispositivos comerciales actuales, fuera del sistema sanitario público y que precisan wearables de elevado coste.
Otro de los problemas es que muchos de los modelos diagnósticos se han desarrollado en pacientes frente a sujetos sanos, es decir, no se han probado en condiciones de la práctica clínica habitual y, por lo tanto, sus resultados no pueden ser generalizables, lo que limita su uso sistematizado.
Por último, en la IA se habla habitualmente de la precisión como medida de valor del modelo, pero rara vez se evalúa el coste de los errores que se pueden generar ni se determina de quién es la responsabilidad si se producen, de modo que, por el momento, solo podemos hablar de herramientas de soporte diagnóstico sujetas a la interpretación del médico.
A pesar de estas limitaciones, el uso de la IA como herramienta de investigación en medicina está creciendo de forma exponencial. Los TM son un claro ejemplo de ello, con un presente y un futuro muy prometedor en el que la IA va a transformar la manera en que atendemos a los pacientes afectados por estas importantes enfermedades neurológicas.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
CONFLICTO DE INTERESES
Los autores no comunican conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
Los autores declaran que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este trabajo no aparecen datos de pacientes.