INTRODUCCIÓN
En 2017, un algoritmo de inteligencia artificial (IA) venció a un experto en Go, uno de los juegos de concentración más complejos. Este software, denominado Alpha Go, supuso un hito en el desarrollo de esta tecnología ya que, por primera vez, fue capaz de englobar un gran número de movimientos y jugadas maestras1. Para su diseño se creó una red para seleccionar el siguiente movimiento (policy network) y otra red para predecir el ganador de la partida teniendo en cuenta los movimientos (value network). Una vez que Alpha Go entendió el razonamiento humano, fue cuestión de entrenamiento y mejora, que culminó con la victoria sobre el experto jugador (reinforcement learning).
En el entorno de la salud digital, la IA podría mejorar la validez diagnóstica, aumentar la velocidad en la toma de decisiones y facilitar la medicina de precisión adaptada a las características individuales de los pacientes2. En los últimos años, la explosión en el incremento de datos biológicos, clínicos y de imagen está facilitando el desarrollo de la medicina personalizada. En especial, la neuroimagen es un modelo perfecto para el desarrollo de algoritmos de IA3. La neuroimagen está basada en complejas decisiones go/no-go que, mediante técnicas de machine learning (ML), pueden ser interpretadas siguiendo el reconocimiento de patrones de imagen parametrizados4. El aprendizaje profundo (deep learning) es una técnica que imita al cerebro humano usando múltiples capas de redes neuronales para la toma de decisiones. De manera muy simplificada, puede decirse que los médicos buscamos las relaciones que entendemos entre dos factores e incluso podemos ver la interacción de un tercer factor confusor. Las redes neuronales, sin embargo, son capaces de integrar muchos más factores (o capas de datos), lo que hace que cuando están bien entrenadas tengan mayor número de aciertos que los médicos expertos (Fig. 1).

FIGURA 1. A: esquema de decisiones go/no-go. B: diferentes modelos de relación entre factores causales, de riesgo y enfermedad. C: diagrama de la arquitectura de una red neuronal multicapa.
Es habitual pensar que la IA ha sido desarrollada para suplantar al ser humano. Sin embargo, actualmente es una herramienta para el desarrollo de sistemas que puedan superar lo establecido; por tanto, se debe presuponer que realizará tareas de manera más eficiente que el humano, puesto que ese es el objeto de su diseño, si bien actualmente hay una serie de aspectos que limitan su actividad de manera plenamente autónoma. Las decisiones médicas son complejas y en general trascienden el árbol de decisión de un algoritmo, sin mencionar las consecuencias que puede acarrear una mala decisión médica5. Por otra parte, los usuarios están poco acostumbrados a ceder sus datos sensibles de salud, por lo que hoy en día incluso los algoritmos bien entrenados no tienen facilidad para representar la individualidad de cada caso6, sin olvidar los sesgos raciales, de género o socioeconómicos cuando el algoritmo aprende de datos que incorporan estos mismos sesgos7.
En este trabajo se revisan someramente algunos de los avances que se están produciendo en el campo de las enfermedades vasculares cerebrales gracias a la IA.
MANEJO DEL ICTUS EN FASE AGUDA
Evaluación clínica
Para detectar un ictus debe realizarse una exploración clínica específica, más o menos simplificada, que requiere un entrenamiento y una formación continuada para su correcta evaluación, lo que limita su aplicabilidad en el entorno sanitario8. El avance tecnológico ha posibilitado el desarrollo de sensores de movimiento (cinéticos) capaces de medir, de manera objetiva, el grado de pérdida de fuerza en las extremidades como signo de afectación de un posible ictus9. En ese estudio se implementó un sistema automático con sensores inerciales adaptados a tejidos (wearables) capaces de reconocer el movimiento y la pérdida de fuerza integrando la información con algoritmos de IA. El sistema presentó una validez del 83,3% (área bajo la curva [AUC]: 0,912) para realizar una evaluación con la escala NIHSS (National Institutes of Health Stroke Scale) de manera automática. Se trata de un sistema capaz de realizar una exploración clínica remota de manera automática, si bien solo sería útil para la detección de un ictus si el individuo dispone de los sensores.
Un gran campo de la IA es el reconocimiento facial automático. Se han publicado experiencias con software que permite detectar la asimetría facial y, por tanto, una paresia facial con alto grado de fiabilidad y sin apenas colaboración del sujeto10. Integrar este sistema en las cámaras de los teléfonos móviles permitiría realizar una valoración remota para la detección de los síntomas de ictus, pero también para evaluar empeoramientos clínicos en el contexto de una fluctuación clínica o una transformación hemorrágica (Fig. 2). Este sistema se podría integrar en los servicios de traslado del paciente en ambulancia para mejorar los flujos de pacientes y reducir los tiempos de tratamiento.
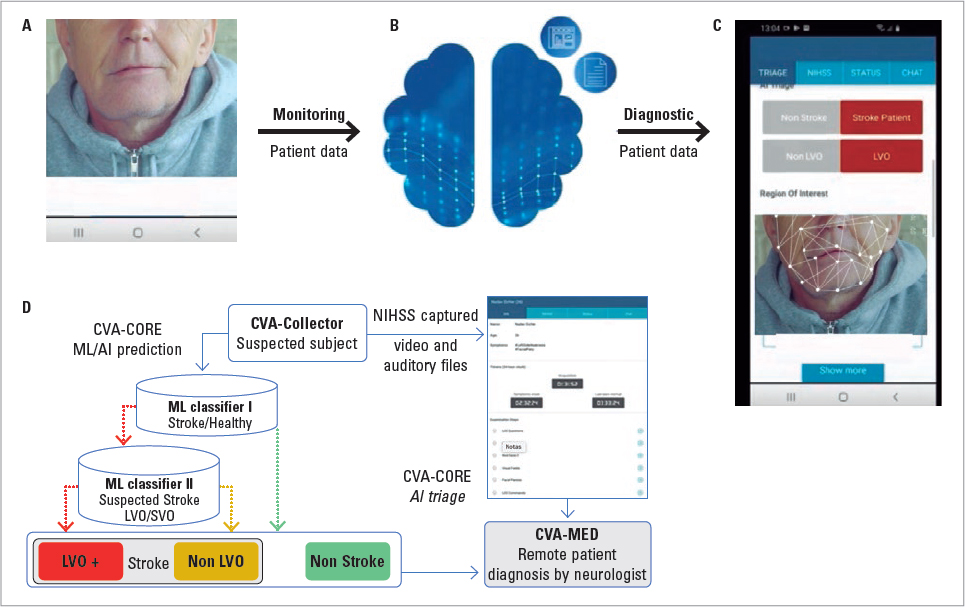
FIGURA 2. A: Reconocimiento facial automático de un paciente con ictus agudo. A: vídeo tomado desde la app. B: análisis de la imagen asistida por IA mediante acceso online al registro médico electrónico. C: notificación a la unidad de ictus. D: el sistema distingue mediante ML entre ictus y no ictus, y en caso de ictus, entre oclusión de gran vaso (LVO) y no oclusión de gran vaso. Fuente: modificación de imágenes de cvaidmedical.com.
Neuroimagen
Una vez en el hospital, es necesario realizar una prueba de neuroimagen para distinguir los casos de ictus isquémicos de los hemorrágicos, ya que los síntomas pueden ser similares, amén de descartar otras causas. Mediante tomografía computarizada (TC) o resonancia magnética cerebral puede determinarse la extensión de la isquemia y su evolución. En caso de detectarse una isquemia por oclusión de un vaso cerebral, el pronóstico dependerá del tiempo que se tarde en detectarlo y tratarlo, haciendo válida la frase «tiempo es cerebro». La efectividad del fármaco trombolítico que se utilice para conseguir recanalizar el vaso obstruido también es dependiente del tiempo, en especial en las primeras horas de su administración (golden hour). La escala ASPECTS (Alberta Stroke Programme Early CT Score) permite valorar el grado de isquemia y el riesgo de presentar complicaciones del tratamiento11. Tras su diseño, la evaluación de esta escala mostró una buena validez interna, con altas sensibilidad y especificidad, pero su aplicación en la vida real muestra limitaciones, con una gran variabilidad interobservador12. Mediante el uso de contraste iónico y técnicas como la TC de perfusión puede aumentarse la sensibilidad para demostrar la presencia de isquemia analizando la velocidad de perfusión de la microcirculación cerebral. En la actualidad existen plataformas de software que permiten realizar un análisis automático de la neuroimagen obtenida, permitiendo mostrar tanto las zonas isquémicas en la TC simple como el grado de isquemia en cada zona de la TC perfusión13. Esto es válido para centros de alta complejidad, pero no para centros intermedios que reciben casos de ictus agudo y no disponen de TC de perfusión. Para solventar este problema, algunos proyectos basados en deep learning han permitido desarrollar algoritmos capaces de detectar la presencia de oclusión vascular en una TC craneal sin contraste, con un valor predictivo positivo superior al 85% para oclusiones proximales del territorio anterior14 (Fig. 3). Además, se han publicado algoritmos similares que pueden analizar la composición del trombo que provoca el ictus para así determinar su resistencia a la recanalización, lo que podría permitir elegir una u otra estrategia de tratamiento intervencionista (aspiración, stent-retriever e incluso angioplastia y stenting)15.
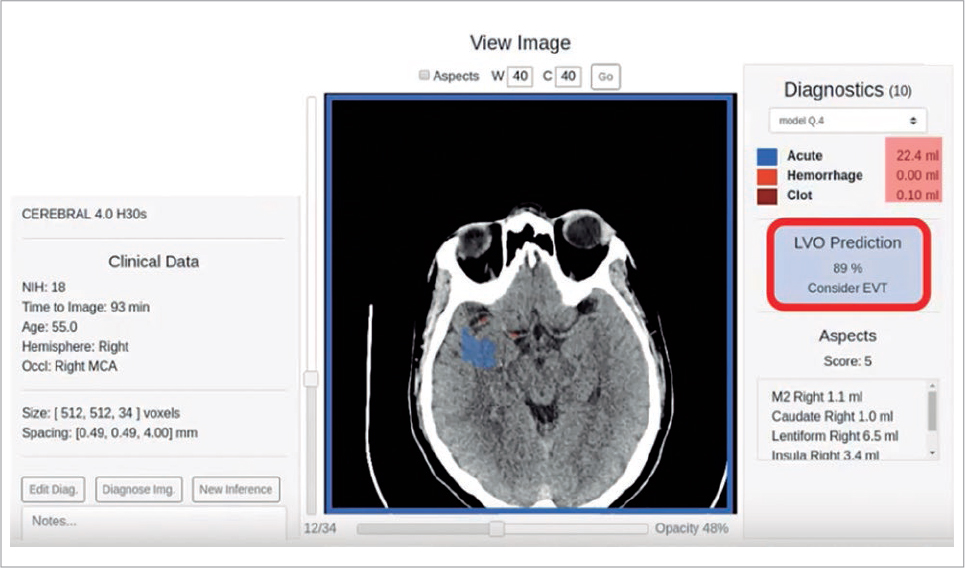
FIGURA 3. Software de análisis automático capaz de detectar una oclusión intracraneal sin presencia de contraste iónico. Fuente: imagen cedida por methinks.ai.
DETECCIÓN DE LA CAUSA DEL ICTUS
Las técnicas de ML permiten saber cuántos pacientes con ictus embólico sin causa conocida (ESUS, embolic stroke of undetermined source) podrían tener una causa cardioembólica oculta16. Esto cobra gran relevancia, ya que algunas de las causas cardioembólicas de ictus, como la fibrilación auricular (FA), requieren tratamiento anticoagulante, mientras que en el ictus criptogénico se recomienda administrar antiagregantes. Según este algoritmo, hasta un 44% de los ictus podrían tener una causa cardioembólica como la FA, con una razón de riesgo por cada 10% de incremento de 1,27 (AUC: 0,68).
Los relojes inteligentes (smartwatches) pueden ayudar a detectar una FA oculta. La FA es una arritmia que afecta a más de 30 millones de personas. Dado que el hecho de tenerla aumenta el riesgo de ictus, se entiende que si se detecta a tiempo se pueden evitar muchos casos17. Para diagnosticar la FA se requiere confirmar la presencia de una arritmia irregular en ausencia de contractilidad auricular, es decir, sin presencia de onda P en el electrocardiograma (ECG). Este ECG se puede realizar de manera digital (iECG) empleando electrodos integrados en un smartwatch. Con una lectura de tan solo 30 segundos se puede obtener fácilmente un iECG de alta calidad18. El desarrollo en el análisis automático de esta señal digital permite que el propio software determine la irregularidad de la señal y, por tanto, la presencia de una posible FA. Este avance convierte al smartwatch en una estrategia de alto interés para el cribado de la FA, ya que son dispositivos de coste limitado y gran aceptación. Tanto los smartwatches como las pulseras de entrenamiento también son capaces de registrar el pulso periférico de manera continua mediante fotopletismografía. Gracias a unos sensores de luz infrarroja se pueden detectar cambios en la microvasculatura capilar con tanta sensibilidad como para diferenciar los cambios del ciclo cardiaco, de modo que cada señal se puede interpretar como una onda del ECG. Mediante el análisis de millones de señales de fotopletismografía se ha conseguido definir el patrón de curva específico que se observa cuando el paciente presenta una FA. Se dispone, pues, de dos formas de detectar la presencia de FA con ayuda de los smartwatches y dispositivos similares: iECG para evaluar de manera puntual la presencia de FA e irregularidad del pulso registrada mediante fotopletismografía. Esta señal de irregularidad se ha integrado en un algoritmo que se ha estudiado en medio millón de pacientes, mostrando en aquellos que presentaron FA un valor predictivo positivo superior al 90%19. Para los neurólogos vasculares, esta segunda posibilidad abre un campo muy interesante en la monitorización de pacientes con ictus criptogénico para detectar una FA oculta, puesto que las herramientas estándar, o son molestas para el usuario, o son caras para el sistema. Finalmente, estos dispositivos requieren ser evaluados en escenarios de la vida real, fundamentalmente en pacientes mayores con problemas de acceso a esta tecnología debido a la brecha digital.
La ecografía ultraportátil es una ecografía realizada con una sonda que se puede conectar a un teléfono inteligente. Esto permite su ultraportabilidad o, en otras palabras, poder llevarla en el bolsillo. Sin embargo, el avance tecnológico no es solo una cuestión de miniaturización, sino que también concierne al desarrollo de algoritmos capaces de detectar normalidad o anormalidad de las estructuras y su movimiento20. El desarrollo de esta tecnología permitirá que, si el dispositivo detecta una alteración, avise al explorador no entrenado para que solicite una ecografía más avanzada, mientras que si el estudio es catalogado como normal no será preciso realizar más pruebas. Este escenario no requiere un experto en neurosonología para realizar el estudio, con lo cual se puede poder llevar la ecografía allá donde esté el paciente.
Predicción de recurrencias, seguimiento y rehabilitación
Cuando un paciente con ictus recibe el alta médica requiere un seguimiento periódico para evaluar su estado clínico, comprobar su adherencia a los medicamentos pautados y revisar el resultado de las pruebas complementarias pendientes; una necesidad que se ve limitada por el gran número de pacientes que deben ser controlados. La importancia en la mejora de los protocolos de prevención secundaria radica en que hasta un 40% de los pacientes podría presentar un nuevo ictus durante los primeros 10 años de seguimiento21.
PREDICCIÓN DE RECURRENCIAS
Un trabajo determinó que conociendo los factores de riesgo vascular más influyentes (edad, colesterol, hipertensión arterial, diabetes, tabaquismo o alcoholismo, actividad física y antecedentes familiares de ictus o enfermedad coronaria) se podría obtener un modelo de predicción suficientemente válido (AUC: 0,83) para establecer la probabilidad de presentar un evento vascular. El modelo calculó un riesgo de ictus en hombres en los siguientes 10 años del 3,92% en el grupo de bajo riesgo y de hasta el 66,2% en el grupo de alto riesgo22. El estudio europeo que engloba la mayor muestra de individuos analizados para la creación de una puntuación de riesgo es el SCORE 2, que incluyó datos de 45 cohortes de 13 países europeos. De esta manera se pudo trazar un mapa europeo de riesgo de mortalidad por ictus empleando modelos ajustados por riesgos competitivos y específicos de sexo, edad, tabaquismo, presión arterial y nivel de colesterol. Para la validación externa se emplearon datos de 25 cohortes adicionales de 15 países europeos. Entre sus resultados destaca que, a igualdad de riesgo vascular, la mortalidad puede llegar a triplicarse en los países de alto riesgo respecto a los de bajo riesgo23.
Se han publicado trabajos de predicción del riesgo de ictus con tan solo una muestra de sangre. En un estudio, el subtipo de colesterol del individuo predijo el riesgo de ictus de manera independiente del resto de los factores de riesgo24. Se han implementado técnicas de ML para la identificación de individuos con alto riesgo de ictus. A diferencia de las escalas de riesgo clásicas para la predicción de eventos vasculares, las nuevas técnicas de ML permiten realizar una predicción basada en factores dinámicos, como sucede con el comportamiento de muchos factores de riesgo. Se ha demostrado, por ejemplo, que la predicción del riesgo vascular para eventos coronarios empleando diferentes modelos basados en ML permite abordar la heterogeneidad y la naturaleza no lineal en la predicción de enfermedades de este tipo, superando a las escalas de riesgo estáticas clásicas25. Por tanto, conocidos los principales factores de riesgo de recurrencia, las bases para el diseño de algoritmos predictivos de recurrencia están servidas, si bien, dada la transcendencia de sus resultados, es crucial que cumplan con los estándares de calidad recomendados para su correcta implementación26.
Seguimiento
El seguimiento puede realizarse mediante apps integradas en dispositivos móviles con sistemas de conversación tipo chat que permitan conectar al usuario directamente con atención especializada sin tener que pasar por el saturado centro de salud ambulatorio, al menos durante los primeros meses27. Este sistema, que requiere un operador al otro lado para resolver las dudas del paciente, podría beneficiarse de plataformas tipo chatbot asistidas por IA para resolver rápidamente y sin demora las dudas más sencillas, permitiendo así seleccionar las más complejas para ser resueltas por el operador. Se han desarrollado sistemas de este tipo para el control de síntomas depresivos en población joven28.
Rehabilitación
La mayoría de los pacientes que han sufrido un ictus requieren rehabilitación. En muchos casos, se trata de seguir unas recomendaciones generales, pero en otros son necesarios unos ejercicios supervisados para ayudar al sujeto más afectado clínicamente. De nuevo, la saturación del sistema obliga a seleccionar a los pacientes para recibir las sesiones de rehabilitación, dada la limitación de los recursos. Se han desarrollado dispositivos que asisten al usuario para poder realizar rehabilitación avanzada29. No debe interpretarse que estos sistemas pueden sustituir al rehabilitador, puesto que las sesiones son complejas, requieren seguimiento y supervisión para comprobar su cumplimiento, y lo que es más importante, soporte emocional al individuo para que continúe con el entrenamiento. La rehabilitación puede realizarse con ayuda de robots asistidos por IA. Estos sistemas permiten realizar sesiones evitando la sobrecarga del rehabilitador y de su equipo.
CONCLUSIONES
La IA está revolucionando la atención a la enfermedad vascular cerebral. El análisis automático de la neuroimagen, junto con la necesidad de tener un resultado rápido y fiable, hacen de este campo un entono ideal para su desarrollo. Por otra parte, al tratarse de un grupo de enfermedades tan prevalente, con gran número de afectados, los sistemas de monitorización, seguimiento y rehabilitación asistidos por IA posibilitarán que un mayor número de pacientes reciban la atención que merecen.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca ni apoyo de un programa de investigación destinados a la redacción de su contenido.
CONFLICTO DE INTERESES
El autor no comunica conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
El autor declara que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
El autor declara que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
El autor declara que en este trabajo no aparecen datos de pacientes.