Introducción
La enfermedad de Alzheimer (EA) es una enfermedad neurodegenerativa crónica con mecanismos fisiopatológicos bien definidos, que afecta sobre todo al lóbulo temporal medial y a las estructuras neocorticales asociativas. Se caracteriza por la acumulación excesiva de proteína beta-amiloide (Aβ) y de proteína Tau fosforilada, así como el daño y destrucción neuronal1. Las placas neuríticas y los ovillos neurofibrilares representan los sellos patognomónicos de la EA, y están relacionados respectivamente con la acumulación del péptido Aβ en los tejidos cerebrales, y con los cambios citoesqueléticos que surgen de la hiperfosforilación de la proteína Tau asociada a los microtúbulos en las neuronas.
En la década de 2010, considerada la era de los biomarcadores, se realizaron importantes progresos en la identificación de marcadores biológicos in vivo en la EA. Se mejoró la capacidad y precisión de medir los niveles de biomarcadores en líquido cefalorraquídeo (LCR). En concreto, los niveles de Aβ (el principal constituyente de la placa) y de proteína Tau (un constituyente de la maraña neurofibrilar), indicativos de la patología cerebral de la EA2.
Conforme nos acercamos al final de la década actual, el dogma de que «la amiloidosis es la EA» está dando paso a un concepto más amplio de la enfermedad. Dado que la patología Tau está más firmemente asociada con el deterioro clínico y cognitivo que la patología amiloide, y puede acumularse en regiones susceptibles antes que la del amiloide, los estudios de intervención farmacológica se están enfocando hacia las vías que alteran Tau2. Con el mayor conocimiento de la fisiopatología de la enfermedad también cobra importancia en la última década el papel de la actividad glial, de manera que los nuevos criterios diagnósticos de la Alzheimer Association ya no hacen solo mención a los marcadores A/T/N, sino que incluyen la proteína ácida fibrilar glial (GFAP) como biomarcador I (inflamación)3.
Según el momento de inicio de los síntomas podemos clasificar la EA en:
- − EA de inicio precoz o familiar (poco frecuente) (30-65 años), antecedentes familiares, involucración de la proteína precursora del amiloide (APP), presenilina-1 (PSEN1) y presenilina-2 (PSEN2).
- − EA de inicio tardío (forma común) (> 65 años), puede involucrar apolipoproteína E e4 (APOE e4).
Factores de riesgo
La EA es una enfermedad multifactorial, y se asocia con múltiples factores de riesgo4. El 40% de los casos de EA se pueden atribuir a 12 factores de riesgo modificables: diabetes mellitus (DM), hipertensión arterial (HTA), obesidad, tabaquismo, consumo excesivo de alcohol, sedentarismo, depresión, inactividad cognitiva, hipoacusia, aislamiento social, traumatismo craneoencefálico y contaminación atmosférica5. En un estudio reciente desarrollado en Reino Unido, en el que se han incluido 40.000 pacientes con análisis previo de imagen cerebral, se identificaron como factores de riesgo modificables más significativos la DM, la frecuencia del consumo de alcohol y la exposición al dióxido de nitrógeno (indicador indirecto de la contaminación atmosférica)5.
El factor de riesgo más importante de la EA es el envejecimiento. Los individuos más jóvenes rara vez padecen esta enfermedad, y la mayoría de los casos de EA tienen un inicio tardío que comienza después de los 65 años.
El 70% de los casos de EA están relacionados con factores genéticos: la mayoría de los casos presentan un patrón de herencia autosómico dominante y mutaciones en los genes dominantes, como APP, PSEN-1, PSEN-2 y APOE4.
Un factor de riesgo genético habitual en la EA esporádica de aparición tardía es el alelo de tipo e4 del gen de la apolipoproteína E (portador de colesterol de lipoproteínas de baja densidad). Situado en el cromosoma 19, se ha descubierto que el alelo APOE e4 está presente en el 50-60% de los pacientes con EA (frente al 20-25% de los adultos mayores sanos), independientemente de que tengan o no antecedentes familiares de demencia6. Recientemente se ha descrito que la homocigosis APOE e4 puede suponer no solo un factor de riesgo para la enfermedad, sino una forma genéticamente determinada7.
Los trastornos relacionados con algunas patologías crónicas como las enfermedades cardiovasculares, la obesidad y la DM, entre otras, aumentan el riesgo de EA. La DM, la obesidad y la HTA son muy prevalentes en la población y pueden acelerar la neurodegeneración y perpetuar la carga de la enfermedad. Según la tendencia global, alrededor del 20% de la población mundial será obesa en 2030. La inflamación periférica, concomitante con la obesidad y la DM, también está directamente relacionada con la EA, como demuestran las mayores concentraciones plasmáticas y del sistema nervioso central (SNC) de interleucina (IL) 6, IL-1b y factor de necrosis tumoral alfa en pacientes con esta demencia8. Asimismo, la alteración de la acción de la insulina puede provocar la acumulación de Aβ y reducir la degradación de la proteína Tau9.
La EA comparte múltiples factores de riesgo con el ictus, como la HTA, tabaquismo, DM y genotipo e4 de APOE, y coexisten en determinados pacientes. La EA suele caracterizarse por la angiopatía amiloide cerebral, que eleva significativamente el riesgo de ictus hemorrágico10.
Epidemiología
La demencia ocupa el séptimo lugar entre las diez principales causas de muerte en el mundo, según el informe 2020 de la Organización Mundial de la Salud (OMS). Según el Observatorio Global de la Demencia (sigla en inglés GDO) de la OMS, en el año 2020 más de 55 millones de personas en el mundo padecían demencia. Con el envejecimiento progresivo de la población se espera un crecimiento exponencial en los próximos años, que podría alcanzar una cifra global de 152 millones de casos en el año 205011.
Según estimaciones de la Sociedad Española de Neurología (SEN), en España hay 800.000 personas que padecen EA, lo que implica el 60% de los casos de demencia. Además, casi un tercio de los pacientes no están diagnosticados. Según datos del Instituto Nacional de Estadística recogidos en la Encuesta de discapacidad, autonomía personal y situaciones de dependencia 2023. Población residente en centros, en el año 2023 un total de 48.783 personas fueron diagnosticadas de EA12.
La EA está infradiagnosticada, principalmente en las fases tempranas de la enfermedad, donde los síntomas son leves. En un estudio reciente realizado en EE.UU., se estimó que solo el 8% de los pacientes con un deterioro cognitivo leve (DCL) habían sido diagnosticados13.
Diagnóstico
La EA progresa a lo largo de un proceso continuo, que comienza con una fase en la que no hay síntomas, pero sí evidencias de biomarcadores de EA (EA preclínica). A continuación progresa a una fase en la que hay anomalías cognitivas menores (DCL) y/o alteraciones neuroconductuales (deterioro conductual leve), y finalmente desemboca en la demencia. El diagnóstico precoz de la EA es esencial para facilitar el desarrollo de terapias modificadoras de la enfermedad y de prevención secundaria antes de la aparición de los síntomas.
Los criterios diagnósticos se basan en información clínica. En un síndrome tan complejo como la EA es necesario establecer una definición biológica de la patología basada en biomarcadores que reflejen la neuropatología subyacente. Las primeras manifestaciones clínicas se relacionan con la memoria, el lenguaje y el pensamiento. Se cree que las alteraciones cerebrales causantes comienzan 20 años antes de la aparición de los primeros síntomas. Con el tiempo, se dañan más neuronas y se afectan más zonas del cerebro, por lo que es clave poder establecer un diagnóstico temprano. El tiempo de supervivencia es dependiente de la edad (empeorando en mayores de 65 años), y de las comorbilidades (DM, enfermedad renal)14.
Es importante establecer un diagnóstico diferencial y descartar aquellos síntomas similares que no progresarán a EA: depresión, apnea del sueño, delirios, efectos secundarios de la medicación, enfermedad de Lyme, alteraciones tiroideas, afecciones cardiacas, tumores cerebrales, déficit de determinadas vitaminas y exceso de consumo de alcohol14.
Es importante considerar si el deterioro cognitivo está relacionado con la edad o se debe a una demencia asociada a EA. Signos de demencia por EA14:
- − Pérdida de memoria que altera la rutina diaria (olvido de información adquirida recientemente).
- − Retos a la hora de planificar o resolver problemas (dificultad para concentrarse y más tiempo para hacer las mismas tareas).
- − Dificultad para realizar tareas familiares.
- − Confusión con el tiempo o el lugar.
- − Dificultad para comprender imágenes visuales y relaciones espaciales.
- − Nuevos problemas con las palabras al hablar o escribir.
- − Extravío de objetos y pérdida de la capacidad de recordar lo ocurrido.
- − Disminución o falta de juicio.
- − Retirada del trabajo o de las actividades sociales.
- − Cambios en el estado de ánimo, la personalidad y el comportamiento.
En 2018, el Instituto Nacional para el Envejecimiento y la Asociación de Alzheimer (NIA-AA) desarrollaron un esquema de trabajo para la clasificación biológica de la EA, el sistema AT(N). Con este esquema de trabajo se armoniza el uso de biomarcadores para identificar y realizar la estadificación del Alzheimer, incluyendo tres categorías de biomarcadores con los que se identifican ocho perfiles biológicos15 (Tabla 1). Las tres categorías de biomarcadores incluyen:
Tabla 1. Perfiles y categorías de biomarcadores en la EA
| Perfiles AT(N) | Categoría del biomarcador |
|---|---|
| A-T-N- | Biomarcadores normales |
| A+T-N- | Cambios patológicos de la EA |
| A+T+N- A+T+N+ | EA |
| A+T-N+ | EA y cambios patológicos concomitantes sospechosos de no ser EA |
| A-T+N- A-T-N+ A-T+N+ | Cambios patológicos no relacionados con EA |
|
EA: enfermedad de Alzheimer. Traducida y modificada de Abdul Manap et al., 202416. |
|
- − Depósitos de Aβ-Aβ (A): tomografía por emisión de positrones (PET) amiloideo o estudio de biomarcadores en LCR: Aβ42 y Aβ42/Aβ40.
- − Agregados de Tau hiperfosforilada (T): Tau PET y p-Tau en LCR.
- − Neurodegeneración o daño neuronal (N): resonancia magnética (RM) estructural, PET de fluorodesoxiglucosa (FDG), Tau total (t-Tau) en LCR y proteína de cadena ligera de neurofilamentos (NfL).
La evaluación del perfil de AT(N) se realiza mediante biofluidos, como el LCR, o técnicas de imagen, como la tomografía por emisión de positrones (PET) (Tabla 2).
Tabla 2. Clasificación de la enfermedad de Alzheimer basada en el sistema AT(N)
| Fluidos biológicos | Pruebas de imagen | ||
|---|---|---|---|
| LCR | Plasma | ||
| A (depósitos de amiloide) | ↓ Aβ42 ↓ ratio Aβ42/Aβ40 |
No se observan alteraciones | PET amiloide (PIB, 18F-florbetapir) |
| T (agregados de tau hiperfosforilada) | ↑ T-tau ↑ p-tau | ↑ T-tau | PET tau (18F-flortaucipir, 18F-RO-948) |
| N (neurodegeneración) | ↑ T-tau ↑ NfL | ↑ NfL | PET-FDG RM |
|
Aβ: proteína beta amiloide; FDG: fluorodesoxiglucosa; LCR: líquido cefalorraquídeo; NfL: neurofilamentos de cadena ligera; T-tau: proteína tau total; p-Tau: proteína tau hiperfosforilada; PET: tomografía por emisión de positrones; RM: resonancia magnética (estructural). Modificada de Janeiro et al., 202017. |
|||
Las evidencias actuales sobre la historia natural de la EA en las personas asintomáticas de riesgo con marcadores biológicos positivos son insuficientes para predecir el posterior deterioro cognitivo y la demencia18. En 2023 se introdujo una revisión de los criterios diagnósticos de la EA teniendo en cuenta los recientes avances en la comprensión de la dinámica temporal de los biomarcadores. Mientras que el amiloide y la Tau siguen destacando en el diagnóstico y la estadificación de la patología, considerándose los marcadores core, el marcador «N» de neurodegeneración ha quedado relegado a un segundo plano junto a la aparición del marcador I. Además, la NIA-AA recomendó incluir los biomarcadores sanguíneos entre los criterios diagnósticos3.
Recientemente, se ha publicado un documento de consenso avalado por la SEN en el que se pone de manifiesto el estado actual de los biomarcadores en sangre para la EA. Dada la alta evidencia recogida en la bibliografía, se resalta la importancia del empleo de biomarcadores en sangre sin demora en las unidades de demencia especializadas. Para ello se recomienda establecer puntos de corte locales. La p-Tau217 es la proteína con los resultados más prometedores y dispone de inmunoanálisis automatizados, lo que facilita su incorporación a la práctica clínica habitual. Desde el grupo de trabajo se recomienda su incorporación progresiva, y se desaconseja actualmente que estos biomarcadores sustituyan al análisis de LCR o a la PET amiloide (pruebas de referencia)19.
Biomarcadores de fluidos corporales
Biomarcadores en líquido cefalorraquídeo
El marcador diagnóstico ideal para la EA debería cumplir al menos tres requisitos básicos:
- − Reflejar los cambios neurobiológicos esenciales posteriores al proceso de la enfermedad.
- − Ser validado mediante estudios post mortem, asumiendo los hallazgos neuropatológicos como criterios de referencia.
- − Ser medible lo antes posible en el proceso continuo de la enfermedad, idealmente en fases presintomáticas.
Además, como requisitos adicionales, incluyen ser no invasivos y sencillos de realizar, precisos y fiables, y adecuados para los cribados a gran escala20.
Dada su inmediata proximidad al tejido cerebral, el LCR constituye una fuente óptima para la identificación de biomarcadores en la EA. Los cambios patológicos que ocurren en el cerebro se reflejan de manera precisa y temprana en el LCR21.
Los principales biomarcadores diagnósticos descritos hasta la fecha son Aβ42 en el LCR, junto con Tau total (t-Tau) y Tau fosforilada (p-Tau). Los pacientes con EA presentan concentraciones bajas de Aβ42, y altas concentraciones de t-Tau y p-Tau en el LCR22.
Este patrón de biomarcadores del LCR, conocido como la «firma de la enfermedad de Alzheimer», refleja las principales características fisiopatológicas de la enfermedad. Su validez se ha confirmado en estudios post mortem, y actualmente es el patrón de estudio más empleado en la práctica clínica.
Se han publicado varios estudios que reflejan la elevada precisión diagnóstica (> 85%) del patrón de LCR para distinguir entre el envejecimiento normal y el diagnóstico de EA, así como un elevado valor predictivo positivo (> 90%). Los pacientes que no muestran déficits progresivos a lo largo del tiempo presentan un patrón de biomarcadores en el LCR muy similar al de los adultos mayores sanos. Estos conjuntos de datos han sido reproducidos por grupos de investigación de todo el mundo y en estudios de metaanálisis23.
El análisis del LCR tiene limitaciones en cada etapa. Antes del análisis, la forma de obtener y manejar las muestras (punción lumbar, manipulación de las muestras y almacenamiento de alícuotas) puede variar mucho. Durante el análisis se emplean distintas técnicas (ELISA y técnicas múltiples) que, aunque precisas internamente (5-10% de variación intralaboratorio), generan resultados muy diferentes entre laboratorios (20-30% de variación interlaboratorio), lo que dificulta la comparación. Después del análisis, la falta de consenso en la definición de valores normales para pacientes y controles dificulta la interpretación de los resultados24.
La categorización de los biomarcadores en el marco de la NIA-AA de 2018 asumió la equivalencia de los biomarcadores de LCR y de imagen dentro de cada categoría AT(N). Sin embargo, la investigación ha demostrado consistentemente que esta asunción no siempre se verifica. En concreto, los ratios AB42/AB40 y pTau/AB42 son los que han demostrado una mayor tasa de correlación con la PET amiloide, cercana al 90%, lo que demuestra el mejor uso potencial de los biomarcadores en combinación que por separado25.
En la actualización de 2024 de los criterios de la NIA-AA, los biomarcadores se dividen en tres categorías principales: biomarcadores que reflejan directamente el daño cerebral causado por la EA; los que indican procesos patológicos que ocurren en enfermedades cerebrales; y los que señalan otras enfermedades no relacionadas con la EA. La revisión también incluye tres nuevas categorías de biomarcadores: mecanismos inflamatorios/inmunitarios (I), lesión cerebral vascular (V) y alfa-sinucleinopatía (S)26 (Tabla 3). Las correlaciones temporales son diferentes en todo el espectro de biomarcadores T. Los fragmentos fosforilados de la región media (Tau fosforilada [p-Tau] 181, 217 y 231) se vuelven anormales más o menos al mismo tiempo que la PET de amiloide y antes que la PET de Tau. La secreción de fragmentos de Tau fosforilados en residuos específicos puede representar una reacción sobre las placas de Aβ, y puede vincular la proteinopatía Aβ con la proteinopatía Tau temprana26.
Tabla 3. Uso de los biomarcadores de LCR y plasma divididos por categorías
| LCR | Plasma | |
|---|---|---|
| Diagnóstico | ||
| A: proteinopatía Aβ | – | – |
| T1: p-tau y t-tau | – | p-tau217 |
| Ratios de interés | p-tau181/Aβ42 t-tau/Aβ42 Aβ42/40 | % p-tau217 |
| Estadio, pronóstico, indicador del efecto del tratamiento biológico | ||
| T1: p-tau y t-tau | – | p-tau217 |
| Ratios de interés | p-tau181/Aβ42 t-tau/Aβ42 Aβ42/40 | % p-tau217 |
| T2: proteinopatía tau | MTBR-tau243, otras formas de p-tau (p-tau205), fragmentos tau no fosforilados de la región media | MTBR-tau243, otras formas de p-tau (p-tau205) |
| N: lesión, disfunción o degeneración del neuropilo | NfL | NfL |
| I: inflamación (activación astrocítica) | GFAP | GFAP |
| Identificación de copatología | ||
| N: lesión, disfunción o degeneración del neuropilo | NfL | NfL |
| S: α-sinucleína | αSyn-SAA | – |
|
αSyn-SAA: ensayo de amplificación de semillas de alfa-sinucleína; Aβ: proteína beta amiloide; GFAP: proteína ácida fibrilar glial; LCR: líquido cefalorraquídeo; MTBR: región de unión a microtúbulos; NfL: neurofilamentos de cadena ligera; T-tau: proteína tau total; p-Tau: proteína tau hiperfosforilada. Traducida y modificada de Jack et al., 202426. |
||
Inicialmente, la medición de amiloide b42, t-Tau y p-Tau en LCR se realizaba mediante plataformas de ELISA. La introducción de plataformas de inmunoensayo «totalmente automatizadas» como Elecsys® (Roche), Lumipulse® (Fujirebio), y Atellica® (Siemens) supuso un avance significativo, permitiendo reducir la variabilidad analítica entre laboratorios27.
Se plantea un esquema de estadificación de solo fluidos, con cuatro etapas que reflejan la siguiente secuencia temporal de aparición de proteínas Tau patológicas: p-Tau181, 217 o 231, seguido de pT205, posteriormente se observa MTBR-Tau243, y finalmente, los fragmentos Tau de dominio medio no fosforilados26.
Biomarcadores en sangre
La accesibilidad de los biomarcadores en sangre es crucial para abordar las limitaciones de la PET amiloide y del LCR en el diagnóstico y seguimiento de la EA. Aunque la información sobre su rendimiento aún está en desarrollo, la capacidad de realizar pruebas a gran escala y su potencial uso en atención primaria (AP) hacen que los biomarcadores sanguíneos sean una promesa real en un futuro próximo, con la previsión de su inclusión en las guías de práctica clínica en los próximos años28.
La plataforma de inmunoensayo ultrasensible Single Molecule Array (SIMOA) ha marcado un avance significativo en la detección de biomarcadores de EA en sangre. Su capacidad para cuantificar concentraciones extremadamente bajas, del orden de picomolar, la distinguen. SIMOA emplea tecnología de recuento digital y se ha aplicado en el análisis de Aβ42, t-Tau, p-Tau y NfL en plasma. Cabe destacar que estudios basados en espectrometría de masas han demostrado ser más sensibles que ensayos tradicionales como ELISA27.
Las concentraciones plasmáticas de Aβ42/Aβ40 disminuyen con el progreso del estado clínico y pueden utilizarse para identificar precozmente la afección. Uno de los principales problemas que plantea la concentración plasmática de Aβ42/Aβ40 es la escasa diferencia observada entre los individuos Aβ positivos y los Aβ negativos. La relación Aβ42/Aβ40 se reduce solo en un 8-15% en plasma en comparación con el 40-60% en LCR debido a la expresión periférica de Aβ29. El cociente plasmático Aβ42/Aβ40, especialmente combinado con la edad y el estado APOE e4, diagnostica con precisión la amiloidosis cerebral y se ha sugerido su uso en el cribado de individuos cognitivamente normales para la amiloidosis cerebral27.
Los inmunoensayos actuales para p-Tau se dirigen a sitios fosforilados en los dominios N-terminal y medio de la proteína Tau, ya que estos fragmentos son más solubles y se liberan al torrente sanguíneo con mayor facilidad que la Tau C-terminal, propensa a agregarse. Valores elevados de p-Tau181 en plasma se asocian con un mayor riesgo de desarrollar patología de la EA en individuos cognitivamente normales o con DCL. Además, la p-Tau181 plasmática puede predecir la conversión a EA hasta ocho años antes del fallecimiento y, en combinación con Aβ42 y los NfL, pueden anticipar la aparición clínica de la enfermedad.
La p-Tau217 plasmática muestra un mayor cambio de plegamiento entre EA y controles comparado con la p-Tau181 y supera en precisión diagnóstica a la p-Tau181 y NfL plasmáticas para EA, aunque es comparable a p-Tau y Tau PET del LCR. También se correlaciona significativamente con amiloide cerebral, PET Tau y PET-FDG. A pesar de la baja concentración sanguínea de p-Tau, los avances recientes en su medición son prometedores27,29.
Se han identificado varios sitios de fosforilación en Tau durante la progresión de la enfermedad. Las formas p-Tau217, p-Tau181 y p-Tau231 aparecen en ovillos neurofibrilares y alrededor de placas Aβ. La p-Tau217 destaca como biomarcador superior a la p-Tau181 debido a su asociación más estrecha con la gravedad de la EA y su capacidad para diferenciarla de otras patologías relacionadas, ya que se encuentra en mayor concentración en cerebros de pacientes con EA.
La p-Tau217 se asocia con la región CA1 del hipocampo, relacionándose con la pérdida neuronal y la formación de ovillos. Detecta con precisión la patología amiloide y Tau, siendo comparable al LCR y superando a la p-Tau181 y la p-Tau231 en amiloide-PET30. Los niveles plasmáticos de p-Tau217 pueden fluctuar tanto dentro de un mismo individuo como entre diferentes personas en función de factores ajenos a la EA, como el índice de masa corporal, la edad o el sexo, lo que representa una posible limitación para su aplicación en el diagnóstico y pronóstico de la enfermedad. Asimismo, diversas comorbilidades, incluyendo ictus, infarto de miocardio y enfermedad renal crónica, pueden aumentar las concentraciones plasmáticas de p-Tau217, reduciendo su precisión diagnóstica en el contexto de la EA30 (Fig. 1).
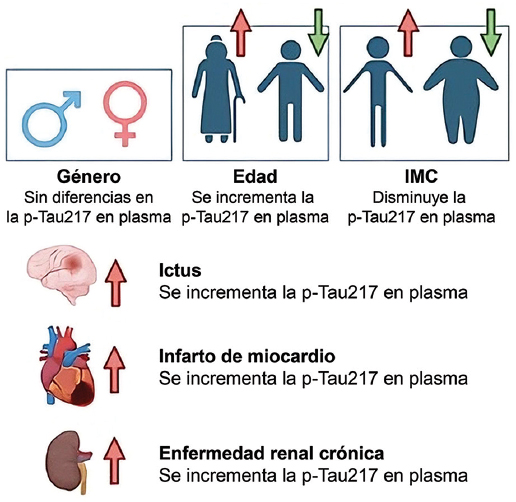
Figura 1. Influencia de diversos factores demográficos y comorbilidades en las concentraciones plasmáticas de p-tau217 (creada mediante https://BioRender.com). IMC: índice de masa corporal.
La última evidencia con pTau217 demuestra que es posible medirla en plasma de forma fiable con métodos automatizados como Lumipulse®, lo que sin duda puede aumentar su disponibilidad en centros. Estos estudios muestran unas tasas de correlación por encima del 90% con el LCR cuando se emplean dos puntos de corte (uno para positividad y otro para negatividad, con una zona de resultados indeterminados intermedia)31,32.
El aumento de NfL en plasma puede anticipar la neurodegeneración cerebral, asociándose con atrofia futura, hipometabolismo y deterioro cognitivo, aunque no es específico de la causa de la enfermedad. Por otro lado, los valores plasmáticos o séricos de GFAP se elevan en la EA, mostrando una fuerte asociación con la patología amiloide cerebral, pero no con la agregación de Tau. Tanto el NfL como el GFAP plasmáticos están vinculados a componentes cerebrales específicos, lo que resalta su potencial como biomarcadores clave de enfermedades del SNC27.
El cociente Aβ42/Aβ40 mostró un efecto temprano positivo, mientras que el NfL surge como marcador en fases tardías. La combinación del cociente Aβ42/Aβ40 y los niveles de GFAP mejora la especificidad para identificar individuos con deterioro cognitivo que progresan a EA, superando el uso exclusivo de la puntuación MMSE y los datos demográficos básicos33.
Los análisis de sangre destacan frente al LCR y los biomarcadores de imagen por su carácter no invasivo, menor coste y reducido impacto en pacientes y sistemas sanitarios. Los estudios sobre p-Tau217 presentan mayor precisión diagnóstica y son de gran utilidad para evaluar la respuesta a tratamientos antiamiloides. Las nuevas técnicas analíticas de alta sensibilidad permiten detectar biomarcadores en concentraciones extremadamente bajas (femtomolar: 1×10-15 molar), aunque su utilidad clínica requiere que el cambio porcentual supere el margen del error analítico total19.
Otros biomarcadores
Se han descrito biomarcadores no plasmáticos, como los obtenidos para el LCR y las imágenes PET, que son útiles para el diagnóstico temprano de la EA34.
Biomarcadores oftalmológicos
La retina, como parte del SNC, experimenta cambios patológicos tempranos en la enfermedad. La variación en el grosor medio de la capa de fibras nerviosas de la retina (RNFL) podría ser un marcador útil para la detección precoz.
Biomarcadores salivales
La saliva es un fluido del que se pueden tomar muestras fácilmente y de forma no invasiva. Valores anormales de biomarcadores salivales pueden indicar la disfunción de los nervios colinérgicos conectados al hipotálamo en etapas tempranas de la EA. La deposición de Aβ en el hipotálamo reduce la lactoferrina salival, correlacionándose con la PET amiloide y destacando su relevancia en la detección precoz.
Biomarcadores respiratorios
En las primeras fases de la enfermedad, el estrés oxidativo mitocondrial genera alcanos y ácidos grasos volátiles de cadena corta que se exhalan a través de los pulmones y pueden detectarse en sangre. Su análisis ofrece un enfoque prometedor para investigar trastornos metabólicos.
Biomarcadores urinarios
La orina puede reflejar estados patológicos mediante metabolitos relacionados con colesterol, nucleósidos, aminas y azúcares, útiles para diferenciar el DCL que progresa a EA. Además, valores elevados de ApoC3, lipoproteína asociada al riesgo de desarrollar enfermedades cardiovasculares y DM2, y biomarcadores de aminoácidos y neurotransmisores desregulados en orina se asocian con EA.
Biomarcadores de imagen
El estudio de deterioro cognitivo, desde la perspectiva de la neuroimagen, puede valorarse de forma anatómica/estructural (estática) o de forma funcional (dinámica) tras la administración de radiotrazadores35.
Resonancia magnética craneal
Constituye la técnica estructural más empleada para el diagnóstico de la EA en práctica clínica. Su utilidad radica en la capacidad para detectar y caracterizar las alteraciones morfológicas típicas de la EA, como la atrofia del lóbulo temporal medial o el adelgazamiento del cíngulo posterior36. Entre los parámetros con mayor valor predictivo de progresión de DCL a EA se encuentran la reducción del volumen de sustancia gris en el hipocampo y parahipocampo, y la presencia de un patrón de atrofia difusa de predominio posterior37.
La RM funcional es una técnica dinámica que permite evaluar la actividad cerebral a partir de los cambios en el flujo sanguíneo cerebral, medidos mediante la señal dependiente del nivel de oxígeno en sangre (BOLD). Esto posibilita el estudio de los patrones de conectividad funcional entre distintas regiones cerebrales. Desde etapas iniciales de la EA, se han evidenciado alteraciones en la denominada red por defecto, implicada en procesos de autorreferencia y memoria38.
PET-FDG
Permite evaluar la actividad metabólica cerebral mediante la administración de un radiotrazador análogo de la glucosa. La disminución del metabolismo regional detectada con esta técnica es interpretada como una pérdida funcional, y el patrón de hipometabolismo cerebral identificado se suele correlacionar con el fenotipo clínico. En EA, las regiones más comúnmente afectadas incluyen el lóbulo temporal medial y las áreas parietales laterales, en contraste con el envejecimiento normal, donde no se observa un patrón específico bien definido35,39.
PET amiloide
Se basa en el uso de radiofármacos como el PIB (Pittsburgh Compound B) o el 18F-florbetapir, con una alta afinidad por las placas amiloides. Se han establecido valores de referencia para tratar de distinguir entre el depósito patológico de amiloide y el fisiológico asociado al envejecimiento. En las fases tempranas de la EA, la acumulación parece concentrarse predominantemente en la corteza parietal medial35.
PET Tau
Actualmente se utilizan trazadores con alta afinidad por la Tau hiperfosforilada, como el 18F-RO-948 o el 18F-flortaucipir. En pacientes con EA, los depósitos de Tau se localizan predominantemente en regiones prefrontales, temporales mediales, parietales laterales, el cíngulo posterior y la corteza occipital. Sin embargo, aún no se han establecido valores de referencia adecuados para su interpretación en práctica clínica40.
Tratamiento
Hasta estos últimos años, el tratamiento específico de la EA ha sido puramente sintomático, sin contar con ningún tratamiento que modificara la historia natural de la enfermedad. Estos primeros tratamientos se dividen en dos grupos: los inhibidores de la acetilcolinesterasa (IACE) y la memantina, y siguen vigentes muchos años después de su aprobación (el último fue la memantina en 2003).
Los IACE (donepezilo, rivastigmina, galantamina) siguen la hipótesis colinérgica, donde la neurodegeneración produciría un déficit de acetilcolina en el SNC, que el fármaco trataría de contrarrestar aumentando su biodisponibilidad. Su beneficio, aunque moderado, está probado, sin grandes diferencias entre ellos en cuanto a eficacia o seguridad41; sus principales diferencias son sus formas de presentación (oral y/o transdérmica en el caso de rivastigmina) y su posología. Están aprobados para fases de demencia leve a moderada.
La memantina por su parte es un antagonista de los receptores glutamatérgicos NMDA, actuando por tanto como modulador de la neuroexcitabilidad a través de la vía glutamatérgica. Al igual que los IACE ha mostrado un beneficio moderado pero probado, con impacto tanto cognitivo como conductual. Está aprobado para fases de demencia moderada a grave41. Se ha demostrado que existe beneficio en el uso combinado de IACE y memantina42, y de hecho recientemente se ha comercializado un comprimido combinado de donepezilo y memantina.
Con estos fármacos mostrando un beneficio moderado y sin cambiar la historia natural de la enfermedad, los esfuerzos han estado centrados los últimos años por desarrollar terapias modificadoras de la enfermedad, siendo los primeros en mostrar resultados significativos los fármacos antiamiloide, que tratan de reducir los depósitos patológicos de proteína amiloide de los cerebros afectos. El aducanumab fue aprobado por la Food and Drug Administration (FDA) en junio de 2021, siendo el primer fármaco aprobado desde 200143, aunque actualmente ya ha dejado de comercializarse.
El lecanemab es un anticuerpo IgG1 humanizado con alta afinidad por las protofibrillas solubles de Aβ previniendo su depósito44, que ha sido aprobado por la FDA en enero de 2023 y recientemente autorizado por la European Medicines Agency (EMA) en noviembre de 2024. El donanemab es un anticuerpo IgG1 dirigido contra un segmento de la Aβ presente en las placas de amiloide, lo que facilita su fagocitosis45. Fue aprobado por la FDA en julio de 2024 y por el momento no ha sido autorizado por la EMA. Ambos fármacos han sido estudiados en fases sintomáticas iniciales de la enfermedad (deterioro cognitivo leve y leve-moderado) y han demostrado no solo una reducción de los depósitos de Aβ en PET amiloide, sino un enlentecimiento del declive cognitivo asociado a la enfermedad44,45.
Aunque los principales efectos adversos de las terapias antiamiloide se relacionan con la infusión, destacan por su potencial peligrosidad las ARIA (amyloid-related imaging abnormalities), alteraciones en neuroimagen que se ven con mayor frecuencia tras terapias. Estas se clasifican en ARIA-E (edema), que son más frecuentes, y ARIA-H (hemorragia), y se clasifican a su vez en leves, moderadas o graves en función de sus características radiológicas. Aunque en su mayoría son asintomáticas (en torno al 90%), ocasionalmente pueden presentarse con síntomas leves-moderados (las más frecuentes son cefalea, confusión, alteraciones visuales) o incluso graves (encefalopatía, crisis epilépticas o déficits focales), por lo que su monitorización mediante RM craneal es obligatoria. Se han desarrollado estrategias para disminuir la prevalencia de ARIA, tanto relativas a la dosificación del fármaco, como a la selección del paciente, por lo que no estaría indicado su uso en pacientes con mayor riesgo de desarrollo de ARIA: anticoagulados, más de cuatro microhemorragias basales u homocigotos para APOE e446. Por este motivo, de cara a la utilización de estos fármacos será obligado el genotipado de APOE.
Implantación en un hospital de tercer nivel
El manejo actual de los pacientes con deterioro cognitivo en nuestro centro se caracteriza por la ausencia de un patrón único en el flujo de pacientes y por la variabilidad en los intervalos entre visitas. Algunos pacientes son derivados directamente desde la consulta de AP a la unidad de deterioro cognitivo (UDC), mientras que otros pasan previamente por la consulta de neurología general. Es recomendable que antes de la primera cita en la UDC, los pacientes hayan realizado pruebas de imagen, como RM. Asimismo, resulta fundamental contar con un «perfil de deterioro cognitivo» en las pruebas solicitadas al laboratorio desde AP, que incluya la determinación de hormona estimulante de la tiroides, ácido fólico y vitamina B12, antes de la derivación a la UDC.
La detección del deterioro cognitivo en fases iniciales requiere una evaluación neuropsicológica desde AP. Es esencial optimizar y unificar los procedimientos de cribado en estos pacientes, dado que actualmente existe una considerable variabilidad en función del médico de AP que realiza la valoración inicial.
Para un diagnóstico preciso de la EA, es imprescindible establecer un protocolo para la PET-FDG y la PET amiloide. Con la aprobación de nuevos tratamientos como el donanemab y el lecanemab, será crucial realizar la determinación de biomarcadores en LCR y el genotipado de APOE e4. Para responder al aumento de la demanda de pruebas de cribado asociadas a estos tratamientos y ofrecer alternativas a la punción lumbar, el estudio de biomarcadores en sangre, como la p-Tau217, jugará un papel clave, una vez que se disponga de mayor evidencia científica y su uso sea incorporado en las guías clínicas (Fig. 2).

Figura 2. Desarrollo e implementación de un algoritmo diagnóstico para la enfermedad de Alzheimer. Coordinación entre atención primaria y atención especializada en un hospital de tercer nivel. *El genotipado de ApoE será imprescindible en la toma de decisiones del tratamiento de pacientes con enfermedad de Alzheimer con los dos fármacos aprobados (donanemab y lecanemab). †Los biomarcadores en plasma aún no se encuentran disponibles para su uso en la práctica clínica habitual y solo se realizan en el ámbito de la investigación. EA: enfermedad de Alzheimer; LCR: líquido cefalorraquídeo; PET: tomografía por emisión de positrones; PET-FDG: tomografía por emisión de positrones con fluorodesoxiglucosa; TSH: hormona estimulante de la tiroides; RM: resonancia magnética; UDC: unidad de deterioro cognitivo.
Financiación
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
Conflicto de intereses
Los autores no comunican conflicto de intereses en relación con el contenido del trabajo.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.