INTRODUCCIÓN
Evaluar el habla y el lenguaje e identificar las trayectorias clínicas y los patrones de neuroimagen del complejo síndrome de la afasia primaria progresiva (APP) es un reto semiológico. Con su descripción en 1982, Mesulam1 definió una entidad neurodegenerativa, inicialmente focal, manifestada como una afasia aislada, al menos durante los dos primeros años2. Evolutivamente, al reducirse paulatinamente el grosor cortical más allá de las regiones lingüísticas, se afectan otros dominios cognitivos y se desarrolla una demencia.
En 2011, la Dra. Gorno-Tempini lideró el consenso internacional para diagnosticar tres principales variantes de APP con base en: la presencia o ausencia de 10 características del habla y el lenguaje, el patrón en neuroimagen y la confirmación biológica3. Sin embargo todavía existen aspectos sin consensuar en el espectro APP por su gran heterogeneidad clínico-radiológica y patofisiológica4. Esta conlleva diferencias en los estudios epidemiológicos y dificultad para calcular su prevalencia, estimada en 3/100.000 hab5. La mayoría de las APP son casos esporádicos con inicio entre los 50-70 años6. El estudio genético se recomienda en formas preseniles con antecedentes familiares de primer grado7.
Las tres variantes de APP son las dos formas afásicas de la demencia frontotemporal (DFT), variante agramatical/no fluente (APPnf) y variante semántica (APPs); y la forma de presentación afásica de la enfermedad de Alzheimer (EA), variante logopénica (APPL). Sus criterios diagnósticos se detallan en la tabla 1. Casi 1/3 de los pacientes3,7 presentan síntomas mixtos o incompletos de alguna variante y se denominan «APP inclasificables» (APPi). Otras formas de afasia primaria previamente descritas (como la afasia dinámica o la anomia pura)8 quedaron excluidas de la clasificación.
TABLA 1. Variantes de APP
| Variante agramatical/no-fluente | Variante semántica | Variante logopénica/fonológica | |
|---|---|---|---|
| Criterios clínicos | Cardinales | ||
| Uno de los dos siguientes: Agramatismo Apraxia del habla | Los dos siguientes: Denominación por confrontación visual alterada Comprensión de palabras aisladas respetada | Los dos siguientes: Dificultad para evocar palabras aisladas en la conversación espontánea y denominación Alteración de la repetición de frases largas | |
| De apoyo | |||
| Dos de los tres siguientes: Alteración de la comprensión de frases sintácticamente complejas Comprensión de palabras aisladas respetada Reconocimiento de objetos respetado | Tres de los cuatro siguientes: Reconocimiento de objetos respetado Dislexia o disgrafia de superficie Repetición de frases normal Ausencia de agramatismo y apraxia del habla | Tres de los cuatro siguientes: Errores fonológicos en la conversación espontánea y denominación Comprensión de palabras aisladas y reconocimiento de objetos respetado Ausencia de apraxia del habla Ausencia de franco agramatismo | |
| Criterios de apoyo de imagen cerebral | Los dos deben estar presentes: Diagnóstico clínico de APPnf La neuroimagen debe mostrar ≥ 1 de los siguientes: – Atrofia predominante fronto-insular posterior izquierda en RM cerebral – Hipometabolismo/ hipoperfusión predominante fronto-insular posterior izquierda en PET/SPECT cerebral | Los dos deben estar presentes: Diagnóstico clínico de APPs La neuroimagen debe mostrar ≥ 1 de los siguientes: – Atrofia predominante temporal anterior en RM cerebral – Hipometabolismo/ hipoperfusión predominante temporal anterior en PET/SPECT cerebral | Los dos deben estar presentes: Diagnóstico clínico de APPL La neuroimagen debe mostrar ≥ 1 de los siguientes: – Atrofia predominante perisilviana posterior o parietal izquierda en RM cerebral – Hipometabolismo/ hipoperfusión predominante perisilviano posterior o parietal izquierdo en PET/SPECT cerebral |
| Criterios de confirmación patológica | Diagnóstico clínico de APPnf y 1 o 2 de los siguientes: – Evidencia histopatológica de una enfermedad neurodegenerativa concreta (DLFT-tau, DLFT-TDP, EA…) – Presencia de una mutación patogénica conocida | Diagnóstico clínico de APPs y 1 o 2 de los siguientes: – Evidencia histopatológica de una enfermedad neurodegenerativa concreta (DLFT-TDP, DLFT-tau, EA…) – Presencia de una mutación patogénica conocida | Diagnóstico clínico de APPL y 1 o 2 de los siguientes: – Evidencia histopatológica de una enfermedad neurodegenerativa concreta (EA, DLFT-TDP, DLFT-tau…) – Presencia de una mutación patogénica conocida |
|
APP: afasia primaria progresiva; APPl: variante logopénica de afasia primaria progresiva; APPnf: variante agramatical/no-fluente de afasia primaria progresiva; APPs: variante semántica de afasia primaria progresiva; DLFT: degeneración lobular frontotemporal; EA: enfermedad de Alzheimer. |
|||
Cada variante tiene áreas específicas de atrofia y/o hipometabolismo/hipoperfusión cortical (Fig. 1), pero la naturaleza neurodegenerativa del síndrome conlleva un solapamiento evolutivo regional, correlacionado con déficits comunes4. Estos dependen de las regiones visiblemente afectadas y también de áreas sin atrofia (inicialmente indetectable) donde hay una reorganización funcional de las redes neuronales que las conectan con las regiones atróficas mediante tractos de sustancia blanca. A pesar del solapamiento, en todas las variantes se mantiene la asimetría izquierda, y por tanto, la afectación intrahemisférica10.
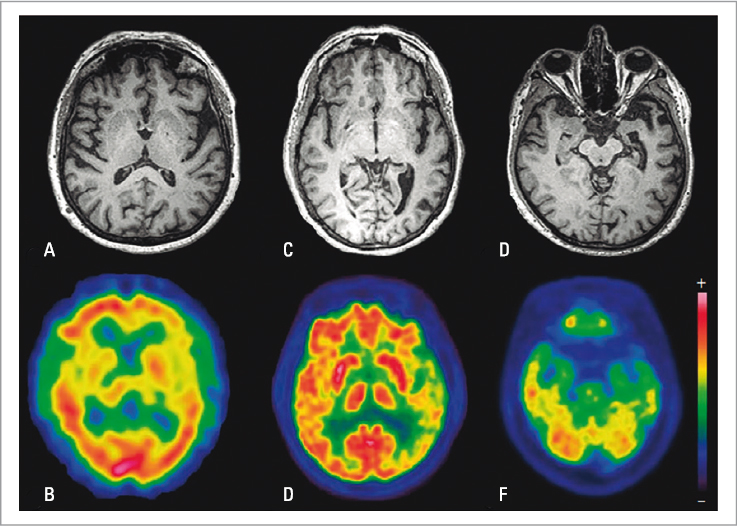
FIGURA 1. Cortes axiales de resonancia magnética y tomografía por emisión de positrones cerebral de un paciente con la variante agramatical/no fluente de afasia primaria progresiva (A,B), la variante logopénica (C,D) y la variante semántica (E,F). Se muestran las regiones típicamente afectadas según los criterios de neuroimagen vigentes de apoyo al diagnóstico clínico (consúltese la Tabla 1) (tomada de Gil-Navarro et al., 2013 9).
Los estudios neuropatológicos (NP) muestran vulnerabilidad selectiva a diferentes proteinopatías, aunque no hay una relación lineal variante APP/sustrato molecular único. La variabilidad puede atribuirse a los diferentes tamaños muestrales, criterios diagnósticos (previos a los actuales) o la presencia de casos familiares8. Los biomarcadores in vivo de EA en neuroimagen y líquido cefalorraquídeo (LCR) han caracterizado mejor la neurobiología APP11. Además, biomarcadores plasmáticos, como los niveles de la cadena ligera de neurofilamentos, correlacionan con el declinar funcional y la progresión de la atrofia en las variantes afásicas de DFT, y pueden tener utilidad pronóstica12.
La logoterapia, mediante intervenciones del habla y el lenguaje, mejora la comunicación funcional de los pacientes. Con la implicación familiar se diseñan actividades no verbales específicas con utilidad práctica en el ámbito sociofamiliar13. Además, el uso creciente de herramientas telemáticas ha permitido una mayor accesibilidad y continuidad terapéutica.
VARIANTE AGRAMATICAL/NO FLUENTE
Se caracteriza por agramatismo (oral y escrito) evidenciado por construcciones sintácticas simplificadas (frases cortas sin morfemas gramaticales como pronombres, preposiciones, conjunciones…), fallos en la conjunción verbal u orden de las palabras. Otro rasgo que puede coexistir es la dificultad en la planificación y programación motora del habla o apraxia del habla (AdH). Esta ocasiona un habla enlentecida y entrecortada14, con distorsiones de los sonidos (trasposiciones, adiciones u omisiones de fonemas), errores fonéticos e intentos de autocorrección15. Se puede asociar a disprosodia y/o disartria. Diferenciar AdH de disartria es complicado. Los errores disártricos son más consistentes, mientras que los de la AdH son más llamativos con la creciente longitud o complejidad de las palabras y/o frases. Además, la disartria no limita los movimientos orolinguales, algo habitual en la AdH, y suele asociar otros síntomas como ataxia, disfagia o hiperreflexia16.
Para algunos autores, la AdH inicialmente aislada, con atrofia selectiva en regiones corticales implicadas en el habla, es una entidad propia denominada «apraxia primaria del habla» (APH)14,16. En ella, el agramatismo puede coexistir evolutivamente y, según su fenotipo clínico, se subdivide en una variante fonética, disprosódica o mixta16. Por el contrario, se habla de «afasia primaria agramatical» cuando el agramatismo predomina sobre la AdH7. Existen opiniones discrepantes sobre diferenciar tres subtipos de APPnf (dependiendo de si agramatismo o APH se asocian o se dan aisladamente) o conceptualizar la APPnf como un espectro sindrómico con déficits cambiantes y solapamiento evolutivo.
En esta variante también se afecta la comprensión de frases sintácticamente complejas, pero la comprensión de palabras y el reconocimiento de objetos están respetados3. Sin embargo, conforme la enfermedad evoluciona, la comprensión de palabras (especialmente verbos) se compromete17. Semiológicamente, los pacientes hierran al elegir alternativas binarias (p. ej., sí/no)18 y no comprenden bien sonidos ambientales o acentos no familiares, especialmente en ambientes ruidosos o por teléfono8.
En la exploración (de inicio o evolutiva) aparece parkinsonismo en mayor proporción que las otras variantes. Bradicinesia, rigidez y alteraciones de la marcha son más habituales que temblor. En ocasiones surge una apraxia ideomotora asimétrica compatible con un síndrome corticobasal16. Menos frecuente es la parálisis supranuclear vertical.
Los criterios de neuroimagen son atrofia e hipometabolismo/hipoperfusión fronto-insular posterior izquierda. Dentro de las subvariantes de la APPnf, la APH asocia una afectación más selectiva en córtex premotor superior y área motora suplementaria, y los casos agramaticales una afectación más extensa en pars orbitalis, triangularis, opercularis y giro temporal superior19. Con la evolución, la patología avanza a regiones posteriores y afecta al córtex temporal posterior y parietal inferior20.
El sustrato NP mayoritario (50-70%) es una taupatía 4R: parálisis supranuclear progresiva o degeneración corticobasal21. La degeneración lobular frontotemporal TDP43 (DLFT-TDP) tipo A aparece en un 20%22. En general, la APH suele predecir taupatía 4R, y las formas agramaticales sin afectación motora una proteinopatía TDP23. En porcentajes menores hay taupatías 3R como la enfermedad de Pick24, mientras que la EA subyace en un 10-25%. En un estudio retrospectivo que incluía biomarcadores in vivo y confirmación NP, un 10% de APPnf tenía una tomografía por emisión de positrones (PET) de amiloide positivo (PETa+)25, pero su diagnóstico NP primario fue de DLFT (tau o TDP), interpretándose la EA como copatología.
Las mutaciones más frecuentes asociadas a APPnf se localizan en MAPT21. A su vez, la expansión C9orf72 asociada a APP suele manifestarse fenotípicamente como APPnf (56% de los casos)26, y esta variante es la segunda forma de presentación afásica de mutaciones en GRN (28%)27. Hay casos minoritarios de mutaciones en TBK128.
VARIANTE FONOLÓGICA/LOGOPÉNICA
Es una variante atípica de EA que también suscita controversias entre expertos. No pertenece al espectro DFT por su sustrato NP mayoritario de EA, y su diagnóstico clínico se basa en la ausencia de criterios core de las otras dos variantes (exceptuando la afectación de la repetición de frases). Mesulam ha sugerido que en algunos pacientes podría ser un estadio prodrómico de APPnf o APPs29.
Su etimología griega (logo-penia o deficiencia de palabras) traduce un lenguaje inicialmente anómico, con pausas de búsqueda por dificultad para encontrar las palabras (fenómeno de «punta de la lengua») por una limitación de acceso al léxico. Las frases son sintácticamente correctas, pero aparecen parafasias fonológicas (de ahí su otra denominación: variante fonológica)30, consistentes en sustituciones, trasposiciones, adiciones u omisiones de fonemas. El lenguaje resultante, entrecortado y con errores fonológicos, puede simular un falso agramatismo. Para el diagnóstico diferencial es fundamental evaluar la repetición verbal de diferente complejidad multisilábica (palabras aisladas, múltiples palabras o dígitos, frases de mayor o menor longitud). La APPL muestra cambios silábicos sin errores articulatorios, y la APPnf dificultades en la iniciación de las silabas y distorsiones de los sonidos.
El rasgo distintivo de la APPL es la dificultad para repetir frases largas30 por afectación de los componentes episódico y fonológico del modelo de la memoria de trabajo de Baddeley31. Según este autor, la memoria verbal a corto plazo depende de un circuito fonológico compuesto por un almacén fonológico (guarda los elementos fonológicos) y un componente subvocálico (mantiene la secuencia acústico-fonética «activa» y ordenada mediante la repetición). El componte episódico retiene e integra temporalmente la información desde la memoria a corto plazo a la memoria a largo plazo, cohesionando las palabras y dando sentido a las secuencias de sonidos. Cuando los pacientes logopénicos repiten frases largas, realizan intentos sucesivos y sustituyen unas palabras por otras similares. Los pacientes con APPnf también presentan dificultad en la repetición de frases por afectación del componente subvocálico, pues tienen limitadas las subvocalizaciones necesarias para mantener «activos» en la memoria a corto plazo todos los fragmentos lingüísticos que requiere la tarea. La alteración de la memoria de trabajo verbal también ocasiona dificultades para comprender frases sintácticamente complejas30,32. La comprensión de palabras está preservada, pues el almacén semántico, al contrario que en la APPs, está indemne (al menos inicialmente).
También hay anomia32, síntoma común a las tres variantes4 y asociado al envejecimiento y comorbilidades psiquiátricas como la ansiedad. Igualmente, en la APPL coexiste ansiedad por la afasia33. En estos pacientes, la anomia se puede justificar erróneamente por la ansiedad, retrasando su diagnóstico. Para evitarlo, la ansiedad de novo o la exacerbación de un trastorno de ansiedad previo en pacientes mayores con queja del lenguaje o memoria debería alertar sobre una posible enfermedad neurodegenerativa34.
Longitudinalmente, el declinar cognitivo de la APPL es más generalizado35 y asocia, con más frecuencia y gravedad que las otras variantes en el mismo momento evolutivo, afectación extralingüística en memoria, praxias o visuoespacialidad. La evaluación de la memoria en la APP es complicada y no está estandarizada. La afasia enmascara el resultado de los test, tanto de memoria verbal (requieren instrucciones y una repuesta verbal)36 como no verbal (p. ej., en la Figura compleja de Rey se requiere comprender una orden y estrategias verbales de codificación para recordar los elementos de la figura)34.
En la exploración pueden observarse mioclonías, bradicinesia o apraxia ideomotora, siendo la APPL el pródromo de un síndrome corticobasal37.
Neuroanatómicamente, hay atrofia en la unión temporoparietal izquierda, en la región perisilviana posterior. Concretamente, anomia y alteración de la repetición de frases correlacionan con reducción del grosor cortical en el giro supramarginal y temporal superior, respectivamente32. Más tarde, la atrofia se propaga anteriormente (mayoritariamente a hipocampo, pero también a córtex frontal inferior, ínsula y precuneus) y contralateralmente (unión temporoparietal, cíngulo posterior y precuneus)2,10. Esta atrofia más generalizada podría justificar los déficit extralingüísticos detectados en los pacientes logopénicos, y suscita el diagnóstico diferencial de una EA con afectación inicial predominante hemisférica izquierda o del lenguaje20.
A nivel NP, la EA es el sustrato mayoritario (55-80%)21 y, congruentemente, los pacientes logopénicos muestran (60-100%) biomarcadores de EA in vivo en LCR9 o PETa+11,25. La segunda causa es una DLFT-TDP (20-35%)38, frecuentemente asociada a mutaciones en GRN, especialmente en los casos sin evidencia in vivo de EA27. En un 5-10% se ha detectado DLFT-tau21 y copatología de cuerpos de Lewy38.
VARIANTE SEMÁNTICA
Sus criterios clínico-radiológicos son buenos predictores del sustrato NP. La queja inicial es la pérdida del significado de las palabras y no la dificultad para encontrarlas2. La afectación del almacén semántico conlleva fallos en comprensión de palabras y reconocimiento de objetos39, y también repercute en dominios no verbales, dificultando el reconocimiento de personas (prosopagnosia).
La anomia es más evidente inicialmente en palabras de baja frecuencia o poco familiares40 y, como los pacientes comprenden las conversaciones por el contexto, pasa desapercibida. Las frases carecen de agramatismo y no hay AdH o pausas de búsqueda como en las otras variantes3. Conforme la APPs avanza, aparece anomia en palabras frecuentes, circunloquios, parafasias semánticas, menos sustantivos específicos y más términos genéricos (p. ej., «cosa» en lugar de «destornillador»)8. Evolutivamente, el lenguaje se vuelve estereotipado y puede aparecer ecolalia.
En la exploración, para evitar la denominación, se puede interrogar por el uso de objetos mostrados (¿Para qué sirve la grapadora?) o por asociaciones concretas señalando objetos dibujados (¿Qué herramienta se usa en el taller?)2. En la lectoescritura aparece dislexia o disgrafia de superficie, de manera que los pacientes regularizan las palabras irregulares según las normas universales de conversión grafema-fonema3.
Los síntomas conductuales son habituales y traducen un fenotipo solapado con la variante conductual de DFT (DFTvc)8. Destacan pérdida del insight y la empatía, dificultad para seguir las normas sociales y rigidez cognitiva40. También se han descrito desinhibición y obsesiones, como el interés desmesurado en sudokus, acertijos o puzles41. En la exploración no suele detectarse focalidad inicial, pero en estadios avanzados pueden aparecer signos de motoneurona42.
La atrofia e hipometabolismo/hipoperfusión del lóbulo temporal anterior izquierdo es característica3. El grado de atrofia correlaciona con la afectación en memoria semántica y tiene un gradiente anteroposterior39, afectando inicialmente la región polar-perirrinal y mesial (córtex entorrinal e hipocampo). Característicamente, al contrario que en la EA, la memoria episódica está indemne, pues la lesión hipocampal es más anterior y tampoco se afecta el cíngulo posterior36. Evolutivamente, hay extensión lesional a córtex temporal posterior, orbitofrontal y polo temporal contralateral43.
Un 30% muestra atrofia inicial asimétrica hemisférica derecha21. Esta «variante derecha de demencia semántica» se asocia a cambios conductuales, alteración del reconocimiento emocional y prosopagnosia. En neuroimagen, el córtex orbitofrontal derecho (vinculado al procesamiento de información socioemocional) está afectado, al igual que en la DFTvc24. Posteriormente, la patología se extiende al lóbulo temporal anterior contralateral, y surge afasia y un solapamiento fenotípico variante derecha/variante izquierda.
La neuropatología de la APPs es altamente predictiva de una DLFT-TDP tipo C (83-100%)22. Un 15% tiene PETa+ in vivo, porcentaje similar a la evidencia de EA en estudios NP26. Hay casos minoritarios con signos extrapiramidales y neuropatología tau por enfermedad de Pick44. Genéticamente, se han descrito pacientes portadores de mutaciones en TBK128 (estos desarrollaron una enfermedad de motoneurona evolutivamente) y C9orf7227.
FORMAS INCLASIFICABLES DE APP
Representan a los pacientes no incluidos en las tres variantes previas3. Es un grupo clínico-radiológico heterogéneo que abarca casos con síntomas aislados, síntomas evolucionados y/o extralingüísticos y solapamiento fenotípico entre variantes. El término APPi (si bien referido en la actual clasificación) es variable en la literatura; por ejemplo, Mesulam habla específicamente de APP mixta en pacientes con agramatismo y afectación de la comprensión de palabras21.
En estudios con biomarcadores, 2/345 y 3/425 de APPi tenían una PETa+ y 3/5 el perfil típico de EA en LCR9. Que un alto porcentaje se asocie in vivo a EA podría justificar el solapamiento fenotípico inicial y los síntomas extralingüísticos evidenciados en algunos de estos pacientes.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
CONFLICTO DE INTERESES
La autora no comunica conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
La autora declara que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
La autora declara que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
La autora declara que en este trabajo no aparecen datos de pacientes.
Uso de inteligencia artificial generativa
La autora declara que no ha utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni en la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.