INTRODUCCIÓN
Las vacunas son la mejor herramienta para evitar la gran morbimortalidad de algunas enfermedades infecciosas, habiendo conseguido en ocasiones su erradicación. Se administran a personas sanas, pero como cualquier otro fármaco, no están exentas de efectos adversos, entre ellos los que afectan al sistema nervioso.
La publicación de un posible vínculo entre las vacunas y enfermedades neurológicas sin evidencia científica crea desconfianza y reticencia en la población a seguir las recomendaciones y participar en las campañas de vacunación, sin tener en cuenta el beneficio en la prevención de infecciones potencialmente graves a nivel individual y poblacional.
Cada vez se van incorporando más vacunas frente a distintos virus, con indicación de dosis de recuerdo periódica en algunas de ellas, sobre todo en población vulnerable.
En este artículo revisamos los resultados de los estudios realizados para confirmar la causalidad atribuida a distintas vacunas en la aparición de trastornos neurológicos a lo largo de la historia, así como el empleo de estrategias de estratificación de riesgo individual de aparición de un evento neurológico tras la vacunación.
MÉTODO
Los datos para esta revisión narrativa han sido recogidos a partir de estudios publicados en inglés desde el año 1977 al 2023. Se realizó búsqueda en PubMed usando las palabras: “neurological disorders and vaccination”, “pharmacovigilance”, “vaccine adjuvants”, “causality assesment of adverse drug reactions” y “lymphocytic transformation test”, seleccionando los artículos (de revisión, de investigación original o de serie de casos) resultantes de la búsqueda, así como también a partir de las referencias bibliográficas de cada uno de los artículos de interés.
ANTECEDENTES DE TRASTORNOS NEUROLÓGICOS RELACIONADOS CON LAS VACUNAS
Virus de la viruela y la rabia
Con la introducción de la vacuna de la viruela desarrollada por Edward Jenner a finales del siglo xviii se reportaron los primeros casos de encefalitis («inflamación cerebral») relacionados temporalmente con la vacunación1. Posteriormente, se describió un «síndrome neuroparalítico» tras la administración de la vacuna atenuada contra la rabia de Pasteur. Esta vacuna producida con tejido de sistema nervioso central (SNC) de conejo infectado indujo encefalomielitis aguda diseminada en el 0,1% de los vacunados2.
Vacuna de la gripe porcina
Durante la campaña de vacunación de 1976 frente al virus de la gripe porcina en Nueva Jersey, se observó un aumento de casos de síndrome de Guillain-Barré (SGB), con un riesgo relativo (RR) para la vacuna de 4,0 a 7,6. En un estudio posterior de casos de SGB en EE.UU. entre septiembre de 1978 y marzo de 1979, con 12 adultos vacunados en las ocho semanas previas (con otro tipo de vacuna antigripal) y 393 no vacunados frente a la gripe, el RR fue de 1,4 (intervalo de confianza del 95% [IC95%]: 0,7-2,7), mucho menor que con el tipo de vacuna empleada en Nueva Jersey. Entre los años 1992-1994 se notificó por el Centro de Control y Prevención de Enfermedades en EE.UU. otro incremento de la incidencia de SGB, pero en la investigación llevada a cabo posteriormente no se demostró un mayor riesgo de SGB asociado a la vacuna de la gripe (RR: 1,7; IC95%: 1,0-2,8; p = 0,04)3.
Vacuna de virus hepatitis B
En la década de 1990 se realizaron programas de vacunación masiva contra el virus de la hepatitis B (VHB) usando el antígeno de superficie recombinante y se publicaron varios casos de inicio o exacerbación de esclerosis múltiple4. Sin embargo, estudios epidemiológicos posteriores no confirmaron ese incremento de nuevos casos ni de exacerbaciones de enfermedades desmielinizantes previas5,6. Además, en un análisis inmunológico no se encontró una mayor la proliferación de células T o citocinas en 10 pacientes con un síndrome desmielinizante que habían sido vacunados de VHB en las 12 semanas previas comparado con pacientes vacunados asintomáticos7.
Vacuna triple vírica
Una mayor repercusión social y mediática ha tenido la posible relación entre la vacuna triple vírica (sarampión, rubeola y parotiditis) y el trastorno del espectro autista, notificada en 1998, a raíz de observar que 10/12 niños con enterocolitis crónica sufrían de autismo y ocho de ellos habían sido vacunados con esta vacuna8. Se encontraron, además, restos de la vacuna del sarampión en el intestino de niños con enterocolitis y autismo9. Taylor et al., en Reino Unido, estudiaron a casi 300 pacientes con autismo nacidos desde 1979 y no se observó un incremento de casos de autismo por año de nacimiento desde que se introdujo la vacuna en 1988, así como tampoco una relación temporal con el inicio de la enfermedad uno o dos años después de la vacunación10. A partir de este y otros estudios, se puede concluir que no se dispone de evidencia que apoye la hipótesis que la vacuna triple vírica cause autismo.
Vacuna neumococo y rotavirus
Se ha observado un mayor riesgo de crisis febriles en las 24 horas siguientes de la administración de distintas vacunas a niños de entre 6 y 60 meses. En 2010, en Australia y EE.UU. se detectó un incremento de ese riesgo tras la inyección de una vacuna inactivada trivalente para la gripe junto con una vacuna conjugada frente al neumococo (PCV13)11.
En 2017, el Comité Consultivo Mundial sobre Seguridad de las Vacunas (siglas en inglés: GACVS; Global Advisory Committee on Vaccine Safety) alertó de que el uso de las vacunas contra el rotavirus podía asociarse con un aumento de riesgo de invaginación intestinal en neonatos. Se trata de una condición médica grave que requiere atención médica urgente, por lo que se recomendó una monitorización de esta posible complicación de la vacuna. En un metaanálisis de 25 ensayos clínicos incluyendo 200.594 participantes, se encontraron 20 casos de invaginación intestinal a los 31 días, 11 casos (55%) en el grupo vacunado y 9 (45%) en el grupo placebo (RR: 1,14; IC95%: 0,49-2,64; p = 0,77), por lo que no se demostró un riesgo significativo12.
Vacuna difteria, tétanos y tosferina
La vacunación con toxoides de difteria y tétanos y con células enteras de tosferina (DTP) se asoció a la aparición crisis febriles y episodios de hipotonía e hiporreactividad. El componente celular de la tosferina se sustituyó por uno acelular (DTaP) comprobando una menor frecuencia de estos efectos adversos13. En modelo animal, la vacuna DTP inducía la producción de la interleucina-1b proinflamatoria en hipocampo e hipotálamo y la aparición de crisis en el ratón con probable relación entre ellas, mientras que estos hechos no se observaron con la DTaP14.
Vacuna varicela zóster
Esta vacuna (VVZ) fue aprobada para su uso en niños en EE.UU. en 1995 y se ha asociado únicamente a reacciones adversas leves (fiebre, reacciones locales y rash). Sin embargo, existen otros dos teóricos riesgos de la vacunación: a) la transmisión del virus atenuado de personas vacunadas a sus contactos, y b) el cambio de tendencia a un número mayor casos de varicela en adultos, que suelen ser más graves3.
En España, actualmente, hay dos vacunas de VVZ autorizadas frente a herpes zóster (HZ). La vacuna Zostavax (ZVL), de la compañía MSD, es una vacuna viva atenuada, que está contraindicada en estados de inmunodeficiencia primaria o adquirida. Y la vacuna Shingrix (HZ/su), de la compañía GSK, que contiene la glucoproteína E del VVZ y el adyuvante AS01B, y tiene una disponibilidad limitada desde 2021 para su administración a mayores de 18 años con patologías de riesgo para HZ y a grupos de edad mayor de 65 años. Ambas vacunas han demostrado su seguridad en ensayos clínicos y estudios postautorización15. Solo recientemente, un análisis de los acontecimientos adversos recogidos por la vigilancia en EE.UU. tras dos años de utilización de la vacuna HZ/su en la población ≥ 50 años ha mostrado un aumento de casos de SGB, con un perfil beneficio-riesgo que sigue siendo favorable16.
Vacuna virus papiloma humano
Tras la instauración de la campaña de vacunación a niñas de 12 años con la vacuna cuadrivalente contra el virus de papiloma humano (VPH), se reportaron en España17 y otros países18 una serie de casos de pérdida de consciencia, así como otros síntomas somatomorfos y disautonómicos, tras su administración19, que generaron una importante atención mediática y una desconfianza pública hacia esta vacuna. Además, se describieron casos de síndromes desmielinizantes del SNC de nueva aparición. Esta vacuna contiene la proteína recombinante de la cápsida L1 del VPH6, 11, 16 y 18 y usa sulfato de aluminio como adyuvante. Sin embargo, no se demostró la relación causal en el estudio de una cohorte en Suecia y Dinamarca que incluyó 4 millones de mujeres entre 10 y 44 años con 789.082 vacunadas entre 2006 y 2013. Los índices de eventos en dos años tras la vacuna comparado con periodos sin vacunación fueron 0,90 (IC95%: 0,70-1,15) para esclerosis múltiple y 1,00 (IC95%: 0,80-1,26) para otras enfermedades desmielinizantes20. Tampoco se confirmó el aumento de riesgo de estos u otros eventos en una revisión sistemática de estudios observacionales poslicencia21. El rango de edad y el sexo de la población vacunada contra el VPH es de mayor riesgo para enfermedades desmielinizantes, lo que puede explicar los casos reportados tras la administración de esta.
Vacuna del virus de la gripe A
En el año 2009, a razón de la pandemia del virus de la gripe A (H1N1) se llevaron a cabo campañas de vacunación masiva en todo el mundo con la vacuna Pandemrix, de GlaxoSmithKline, con ASO3 como adyuvante, que contiene DL-a-tocoferol y polisorbato 80. En el año siguiente, las notificaciones a los sistemas de farmacovigilancia sugerían un aumento de la incidencia de narcolepsia-cataplejia asociado a la administración de la vacuna en niños y adolescentes. Numerosos estudios retrospectivos en países del norte de Europa mostraron un incremento de la incidencia relativa de narcolepsia en niños vacunados de 3 a 17 veces22. Sin embargo, se detectó un menor riesgo en Canadá donde se utilizaba la vacuna Arepanrix, también con ASO3 como adyuvante pero que difería sutilmente en su composición23, y no se reportó un incremento de riesgo con las vacunas sin adyuvante o con MF59 en lugar de ASO324.
En la aparición de la narcolepsia-cataplejia intervienen factores ambientales y de susceptibilidad genética. El HLA-DQB1 06:02 está fuertemente asociado (odds ratio [OR] > 250). Esta asociación de la narcolepsia con HLA apoya la hipótesis de un origen autoinmune de la enfermedad. Los esfuerzos para identificar anticuerpos específicos contra la orexina, las neuronas hipotalámicas, o contra antígenos neuronales han sido infructuosos, y se sugiere un papel predominante de las células T CD4+ y CD8+. Aunque el 12-38% de la población tiene el alelo HLA-DQB1 O6:02 solo una pequeña proporción de pacientes vacunados con Pandemrix desarrollaron la enfermedad25. En China se reportó un incremento de narcolepsia tras la propia infección por el virus H1N1. Es posible que este virus active células T patogénicas y que estas sean potenciadas posteriormente por efecto de la vacuna, aunque en el estudio de Finlandia no había evidencia serológica del virus H1N1 en niños con narcolepsia que habían sido vacunados26. En otro estudio más reciente de cohorte retrospectiva en Suecia se vio únicamente un leve incremento en el riesgo asociado de parálisis de Bell (hazard ratio [HR]: 1,25; IC95%: 1,06-1,48) y parestesias (HR: 1,11; IC95%: 1,00-1,23) con la vacuna Pandemrix27. El uso de adyuvantes en las vacunas de la gripe se ha sugerido como un posible desencadenante de eventos adversos27,28.
Vacuna de SARS-CoV-2
La pandemia de COVID-19 declarada en marzo del 2020 obligó a llevar a cabo una gran actividad investigadora para el desarrollo de vacunas frente al coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2). Un año después, en marzo del 2021, ya existían cuatro vacunas para la COVID-19 autorizadas en la Unión Europea29. Para la creación de dos de ellas (BNT162b2, de Pfizer-Biontech y mRNA-1273, de Moderna), se utilizó una tecnología novedosa como es la inoculación de ARN mensajero, que codifica una forma de la proteína de espiga del SARS-CoV-2 y que, tras ser vehiculizado por nanopartículas de lípidos, es absorbido por las células del sujeto para su producción. En las otras dos vacunas (ChAdOx1, de AstraZeneca y Ad26.COV2.S, de Janssen) se utilizó un vector viral no replicante. En general, todas las vacunas aprobadas mostraron un buen perfil de seguridad en los ensayos clínicos y estudios poscomercialización. Sin embargo, se han descrito una serie de trastornos neurológicos acontecidos tras su administración, siendo los segundos en frecuencia después de los locales a la inyección y de los fenómenos de reactogenicidad sistémica, que incluyen dolor local, cefalea, mialgias y fatiga30. Se han descrito casos de paresia facial, cefalea, crisis epilépticas, hemianopsia, afasia, somnolencia aguda, dificultad para caminar, contracciones musculares y opsoclonus-mioclonus31, así como una mayor ocurrencia de SGB, parálisis de Bell y neuralgia amiotrófica32,33. Además, con las vacunas de vector adenoviral (ChAdOx1 y Ad26.COV2) se han observado casos de trombosis venosa cerebral asociada a trombocitopenia trombótica inmune34. En España, se notificaron del 1 de febrero al 26 de septiembre del 2021, 61 casos (4/1000000 dosis), de los que 45 cumplían criterios (82% mujeres, edad: 30-49 años), con desenlace mortal en 11 casos (24,4%), asociado a mayor trombocitopenia y presencia de hemorragia intracraneal35.
Aunque la impresión es que la vacuna COVID-19 se asocia a un mayor número de complicaciones neurológicas de origen disinmune que otras vacunas, el reporte de todos estos eventos adversos ha sido inconsistente y el número de casos graves bajo36, con un número creciente de trastornos neurológicos funcionales descritos posvacunación37.
Todavía se necesitan más estudios epidemiológicos para aclarar el grado de riesgo de trastornos neurológicos autoinmunes de las distintas vacunas frente a COVID-19, y los factores asociados que pueden incrementar este riesgo. Desde el año 2022, en España, se realiza una campaña de vacunación conjunta frente a COVID19 y gripe A y B, y se desconoce si la administración de ambas vacunas a la vez puede provocar un mayor número de reacciones adversas.
MECANISMOS FISIOPATOLÓGICOS DE LOS SÍNDROMES NEUROLÓGICOS TRAS LA VACUNACIÓN
El mecanismo más aceptado como responsable de las reacciones adversas de las vacunas es el de mimetismo molecular en el que el antígeno presente en la vacuna posee un epítopo similar a algún antígeno del huésped, con lo que se activan las células presentadoras de antígeno que a su vez activan células T autorreactivas y la liberación de citocinas (como interleucina [IL] 1, IL-6, factor de necrosis tumoral alfa y prostaglandina-E2), que activa una cascada proinflamatoria38. La activación patogénica de las células B y la producción de nuevos anticuerpos antineuronales39 también puede provocar un daño al sistema nervioso. Además, el fenómeno de propagación de epítopos antigénicos aumenta la respuesta inmunitaria patológica40.
Las vacunas inactivadas necesitan de adyuvantes que aumenten la capacidad de desencadenar la respuesta inmunitaria y el mantenimiento en el tiempo de esta. Como adyuvantes, se han utilizado muy diferentes compuestos: aluminio (en vacunas de difteria, tétanos, hepatitis A y B, ántrax), aceites (MF59 y AS03 en vacuna de la gripe), combinación de hidróxido de aluminio y monofosforil lípido A (AS04, usado en VHB y VPH), MPL y saponin QS-21 (AS01B, en VHB y malaria), etc.41.
Se han descrito algunas complicaciones causadas por los adyuvantes, conservantes o contaminantes añadidas a la vacuna, como por ejemplo, la miofascitis macrofágica por aluminio, o la neurotoxicidad por timerosal, derivado del etilmercurio, en niños. Se ha sugerido, incluso, que la transmisión del agente de la encefalopatía espongiforme bovina transmitido por la vacuna fue el responsable de picos de scrapie en Italia en 1997 y 1998, por lo que recomienda no utilizar materiales de animales procedentes de países con casos de encefalopatía espongiforme bovina3.
En el campo de las vacunas, la búsqueda por adyuvantes más seguros y eficientes es constante. En este contexto, surgen los adyuvantes de nueva generación, que se basan en mecanismos de acción novedosos y aprovechan los últimos avances en la inmunología para estimular la respuesta inmunitaria de manera más específica y dirigida.
Algunos ejemplos de adyuvantes de nueva generación incluyen42:
- Agonistas de receptores toll-like (TLR): estos adyuvantes imitan a los patógenos y activan directamente las células del sistema inmunitario, induciendo una respuesta Th1 robusta y duradera. Ejemplos incluyen: CpG, Pam3CSK4 y flagelina.
- Partículas a base de lípidos: estas partículas pueden encapsular antígenos y adyuvantes, mejorando su entrega a las células inmunitarias y potenciando la respuesta inmunitaria. Ejemplos incluyen: liposomas, nanovacuolas e ISCOM.
- Sistemas de liberación controlada: estos sistemas liberan el antígeno y el adyuvante de manera gradual, lo que permite una respuesta inmunitaria más sostenida y controlada. Ejemplos incluyen: microesferas biodegradables y nanopartículas de polímeros.
Los adyuvantes de nueva generación representan una importante área de investigación en el desarrollo de vacunas. Estos adyuvantes prometen vacunas más seguras, efectivas y duraderas, con el potencial de proteger a las personas de una amplia gama de enfermedades infecciosas y mejorar la salud pública a nivel global.
Las vacunas contra la COVID-19 basadas en ARN mensajero, vehiculizado por nanopartículas de lípidos, contienen componentes no utilizados hasta ahora, como el polietilinglicol (PEG) 2000 en las vacunas de Biontech/Pfizer y Moderna. Además, la vacuna de Moderna contiene trometamol como excipiente, mientras las vacunas de Janssen y Astra-Zeneca contienen polisorbato 80 (P 80), un emulsionante y surfactante usado frecuentemente en fármacos, cosméticos y comidas. La vacuna de Astra-Zeneca contiene, además, ácido etilendiaminotetraacético (EDTA).
Algunos de estos excipientes podrían ser la causa de los trastornos inmunitarios por un mecanismo de hipersensibilidad retardada o tipo IV. En un estudio del papel de estos excipientes en la estimulación inmunitaria en pacientes con reacciones neurológicas tras la vacuna COVID-19 hubo un 50% de positividad al test de transformación linfocitaria con PEG 2000 y/o P 8043.
ESTUDIOS DE CAUSALIDAD. ALGORITMOS DE FARMACOVIGILANCIA
Aun existiendo una relación temporal y plausibilidad biológica, es complicado definir la causalidad de las vacunas en los síndromes neuroinmunes acontecidos después de su administración. Muchos de estos síndromes, como el SGB, la encefalitis o las neuritis craneales, ocurren también influidos por factores genéticos u otros factores ambientales de estímulo del sistema inmunitario (p. ej., infecciones), a veces desconocidos.
El primer paso para estudiar la posible relación de la vacuna con un incremento en la incidencia de estos trastornos sería conocer las tasas de enfermedad en la población previo a la vacunación y comparar con las posteriores a esta. Pero existe una limitación en cuanto a los registros de casos tanto de estas enfermedades como de las reacciones adversas a fármacos. A pesar del esfuerzo, mediante la creación de sistemas de notificaciones accesibles a cualquier médico (en España, la base de datos de Farmacovigilancia Española, Datos de Reacciones Adversas o FEDRA), hay una tendencia a no reportar los posibles casos por parte de los profesionales que asisten a los pacientes, incluso cuando las complicaciones son graves.
Bradford Hill definió nueve criterios necesarios para establecer una causalidad en epidemiología, que son: 1) fuerza de asociación; 2) consistencia de los resultados; 3) especificidad del efecto; 4) secuencia temporal; 5) gradiente biológico (dosis-respuesta); 6) plausibilidad biológica; 7) coherencia; 8) experimentación, y 9) razonamiento por analogía44.
La concreción en farmacovigilancia de estos criterios se realiza habitualmente mediante algoritmos. En España se utiliza el algoritmo del Sistema Español de Farmacovigilancia, el cual es una modificación del publicado por Karch y Lasagna45 y consta de siete preguntas que el clínico se plantea ante una relación medicamento-efecto adverso (Tabla 1).
TABLA 1. Algoritmo de causalidad del sistema español de farmacovigilancia
| Puntuación | |
|---|---|
| Secuencia temporal | Compatible (+2) |
| No totalmente compatible (+1) | |
| No información (0) | |
| Incompatible (–1) | |
| Síndrome de abstinencia (+2) | |
| Conocimiento previo, bibliografía | Reacción descrita en la ficha técnica o en los libros de referencia (+2) |
| Reacción publicada una o dos veces en una revista científica o base de datos (+1) | |
| Desconocida (0) | |
| Hay información farmacológica en contra de la relación medicamentosa (–1) | |
| Efecto de la retirada | La reacción mejora con la retirada (+2) |
| La reacción no mejora con la retirada (–2) | |
| La reacción no mejora, y no hay retirada (+1) | |
| La reacción mejora y no hay retirada (–2), | |
| No hay información (0) | |
| Muerte o efecto irreversible (0) | |
| La reacción mejora por desarrollo de tolerancia, a pesar de no retirar el medicamento (+1) | |
| La reacción mejora con su tratamiento, o a pesar de no retirar el medicamento (+1) | |
| Reexposición | Positiva (+3) |
| Negativa (no reaparece) (–1) | |
| No reexposición o no información (0) | |
| Muerte o efecto irreversible (0) | |
| Positiva para otra especialidad con el mismo principio activo (+1) | |
| Reacción similar con otro fármaco con mismo mecanismo de acción o reactividad cruzada (+1) | |
| Causas alternativas | Sí, una enfermedad u otro medicamento es más probable que sea la causa (–3) |
| Sí, verosimilitud parecida para el medicamento y otras causas (–1) | |
| No hay información suficiente (0) | |
| No hay suficiente información para descartar las causas alternativas (+1) | |
| Factores contribuyentes | Sí (+1) |
| No (0) | |
| Exploraciones complementarias | Sí (+1) |
| No (0) | |
| La puntuación final determina la probabilidad de la reacción: | |
| Menos de 0: no relacionada; 1-3: condicional; 4-5: posible; 6-7: probable; 8: definida | |
En el caso de las vacunas, se ha de tener en cuenta distintos aspectos:
- En la valoración de la compatibilidad de la secuencia temporal entre la administración de la vacuna y la aparición del evento adverso, se estableció por consenso un tiempo de seguimiento en los ensayos clínicos de 12 semanas.
- En vacunas de reciente autorización es posible no encontrar reseñas bibliográficas previas de efectos adversos, por lo que puede infraestimarse la puntuación del apartado de conocimiento previo.
- El efecto de retirada no es puntuable, puesto que las vacunas no son fármacos de administración continua.
- En los síndromes inmunomediados hay que tener en cuenta como causas alternativas o desencadenantes las infecciones previas o procesos neoplásicos, así como la administración conjunta de otro fármaco frente al que pueda haber también reacciones de hipersensibilidad.
- Sufrir alguna enfermedad del sistema inmunitario o autoinmune crónica de base, o ser portador de algún alelo génico predisponente puede ser un factor contribuyente a una reacción posvacunal.
- Las exploraciones complementarias, además de confirmar una lesión en el sistema nervioso y de descartar otras causas, deberían ser útiles para valorar la respuesta inmunitaria específica al fármaco.
Aunque estos algoritmos son útiles para evaluar la causalidad de las reacciones adversas a medicamentos, porque clasifican de forma semicuantitativa la probabilidad de la relación, mejoran su base científica y califican de forma individual cada caso, tiene sus limitaciones. Se ha encontrado un bajo grado de concordancia entre centros en los que se reevaluaron 50 notificaciones46. El poder del sistema para discriminar entre categorías próximas, tales como «posible» y «probable», y la utilidad en casos de desenlace mortal, son bajos. En algunos estudios estos algoritmos de causalidad han mostrado una elevada sensibilidad (casi 100%), pero una baja especificidad (37,5%)47, por lo que son necesarios test más precisos que confirmen la asociación fisiopatológica entre las vacunas y los síndromes neurológicos.
TÉCNICAS DE LABORATORIO EN DESARROLLO PARA EL ESTUDIO DE LAS REACCIONES ADVERSAS A VACUNAS
En la búsqueda de biomarcadores que nos ayuden a diagnosticar los síndromes neurológicos secundarios a vacunas nos encontramos con la falta de especificidad de los mecanismos inmunológicos, que pueden producirse de la misma forma en reacciones posvacunales, en postinfecciosas o en idiopáticas. Las vacunas de la COVID-19, por ejemplo, han demostrado provocar un importante incremento de citocinas inflamatorias, fagocitosis, reclutamiento celular, activación de complemento y reacción de células T, que simula la respuesta inmunitaria de la propia infección por SARS-CoV-248.
Se han encontrado resultados inconsistentes en cuanto a la asociación entre los niveles de anticuerpos anti-proteína de la espícula del SARS-CoV-2 y la aparición de reacciones sistémicas tras la vacuna, los niveles de anticuerpos parecen ser más altos si hay una reacción sistémica tras una segunda dosis49,50, pero el estudio de valores cuantitativos de respuesta inmunitaria, como los niveles de anticuerpos o de otros biomarcadores inmunológicos, puede no ser útil como predictor de síndromes neurológicos posvacunación debido a la dificultad en establecer un punto de corte, a la variabilidad de la respuesta inmunitaria en el tiempo en un mismo sujeto y a la falta de especificidad (similar en eventos secundarios al fármaco o a otros desencadenantes).
El test de transformación linfocitaria (TTL) puede ser una herramienta útil en el diagnóstico de las reacciones de hipersensibilidad tardía a fármacos. Este test in vitro detecta y cuantifica la proliferación de células T de memoria específicas para un fármaco después de una coincubación de las células mononucleares periféricas del paciente con el fármaco o excipiente de interés. Si las células presentadoras de antígenos del paciente presentan el antígeno a las células T de memoria específicas del medicamento, se produce su activación y expansión. Se incorpora tritio (3H-timidina) en el ADN de las nuevas células, lo que permite cuantificar la proliferación al medir la radiación (Fig. 1). Se debe realizar después de la recuperación del evento y al menos un mes después de la suspensión de la terapia con esteroides51.
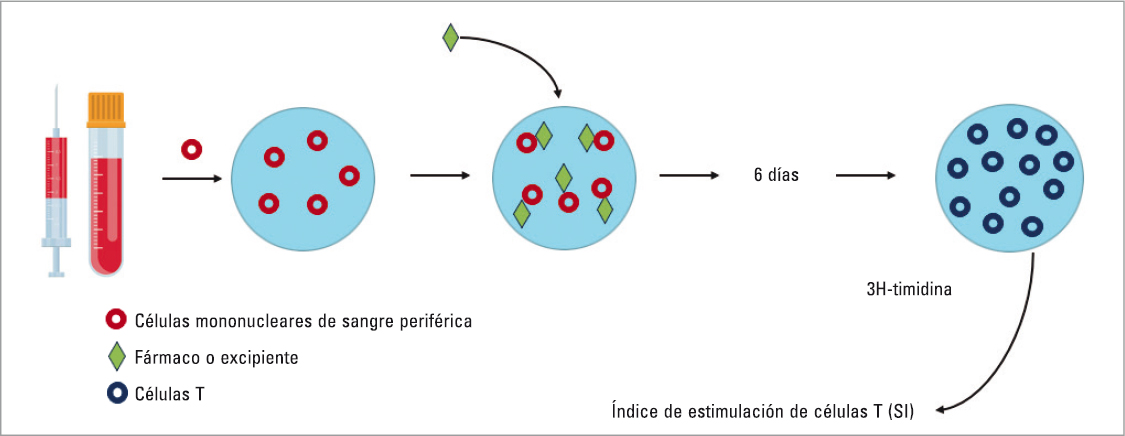
FIGURA 1. Test de transformación linfocitaria.
Aunque el TTL parece una técnica prometedora para la identificación de los excipientes de vacunas como responsables de las posibles reacciones adversas, se necesitan más estudios, con análisis de la tolerancia a nuevas dosis de vacunas, para conocer la utilidad del TTL en establecer recomendaciones, por ejemplo, en cuanto a la revacunación con un mismo o distinto tipo de vacuna.
CONCLUSIONES
La vacunación ha sido una de las más importantes contribuciones a la salud pública de la historia de la medicina, y debe continuar el esfuerzo de investigación sobre esta y la transparencia en la información, para mejorar la confianza de la población en sus beneficios.
La incidencia de los eventos neurológicos graves tras la vacunación es tan baja que pueden no detectarse en ensayos clínicos. Es necesario fortalecer los sistemas de farmacovigilancia continua, así como realizar estudios poscomercialización epidemiológicos con una metodología y una evaluación de los resultados correctas, para conocer la verdadera asociación entre las distintas vacunas y los trastornos neurológicos ocurridos tras su administración.
Los estudios de causalidad, con los algoritmos de farmacovigilancia y las técnicas de laboratorio en desarrollo, tienen un papel fundamental para avanzar en la comprensión de las reacciones adversas a las vacunas y mejorar la seguridad en su uso.
FINANCIACIÓN
La autora Laura Lacruz ha recibido una beca Dr. Luis Álvarez 2023 del Instituto de Investigación Hospital La Paz (IdiPaz) en modalidad intensificación, como apoyo al trabajo: Trastornos neurológicos inmunomediados tras vacunación frente a COVID-19 y gripe. Utilidad de los estudios de inmunidad en suero, relacionado con el tema de este artículo.
CONFLICTO DE INTERESES
Los autores no comunican conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
Los autores declaran que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este trabajo no aparecen datos de pacientes.
Uso de inteligencia artificial generativa
Los autores declaran que no han utilizado inteligencia artificial generativa en la redacción de este manuscrito. Se ha utilizado la aplicación Copilot de Microsoft 365 en la traducción al inglés del resumen y en el diseño de la Tabla 1.