IMPORTANCIA DEL ICTUS PEDIÁTRICO
La Organización Mundial de la Salud define el ictus como «el rápido desarrollo de manifestaciones clínicas de afectación local (o global) de la función cerebral, con síntomas que duran 24 horas o más, o que conducen a la muerte, sin causa aparente que no sea de origen vascular»1.
Existen diferencias entre niños y adultos, siendo en ambos casos una emergencia neurológica, en la que es necesaria una atención rápida para poder aplicar medidas terapéuticas que limiten el daño cerebral. En los adultos representa la segunda causa de muerte en el mundo, y la tercera causa conjunta de muerte y discapacidad2. En los niños es una de las 10 causas principales de mortalidad: 7-28% para el ictus isquémico y 6-54% para el hemorrágico; además, en los supervivientes existe un alto riesgo de morbilidad (alrededor del 80% presentarán secuelas a largo plazo), lo que implica déficits neurológicos permanentes. La calidad de vida se verá afectada en este grupo de población, cuya esperanza de vida es inherentemente mayor que en los adultos. Las principales secuelas que presentan son motoras, en un 50-80% de los casos, seguidas de dificultades en el aprendizaje y el desarrollo de funciones cognitivas en un 30-67% y de alteraciones del lenguaje en un 30%3.
Entre todos los ictus en la edad pediátrica, la prevalencia del ictus hemorrágico es del 35-54%, a diferencia de lo que ocurre en los adultos, en quienes esta es inferior (7,5-19%). Dicha prevalencia, junto con otras variables, contribuye al incremento en la tasa de mortalidad del ictus hemorrágico pediátrico4.
Aunque el ictus es menos frecuente en los niños que en los adultos, su impacto social, mortalidad y morbilidad a medio-largo plazo son mayores. Por lo tanto, es de gran importancia establecer un diagnóstico precoz. Sin embargo, como se recoge en la literatura, la realidad es que con frecuencia existe un retraso en el diagnóstico5. Dada la similitud con otras patologías, la ausencia de signos patognomónicos y la gran variabilidad de los síntomas, el ictus en los pacientes pediátricos suele diagnosticarse inadecuadamente ante la falta de sospecha clínica. Solo alrededor del 25% de los niños con síntomas neurológicos significativos serán diagnosticados de ictus6.
Según los datos recogidos en el año 2021 por el Instituto Nacional de Estadística (INE), en la encuesta de morbilidad hospitalaria con diagnóstico de enfermedad cerebrovascular, hubo 20 altas hospitalarias en menores de 1 año y 204 altas hospitalarias en el rango de 1 a 14 años. En lo referente a la mortalidad, en el mismo periodo, se registraron dos defunciones en menores de 1 año y cinco en el rango de 1 a 14 años7. Según estos datos epidemiológicos y, teniendo en cuenta la población pediátrica de referencia de nuestro hospital (aproximadamente 70.000), se esperaría encontrar una media de nueve ictus anuales, de los que cinco serían isquémicos.
Es posible mejorar la evolución y el pronóstico de estos pacientes, así como su calidad de vida, con medidas de neuroprotección temprana y, en determinados casos, mediante terapias de reperfusión aguda8.
Actualmente, el Grupo de Ictus Pediátrico de la Sociedad Española de Neurología Pediátrica trabaja en la creación de una red nacional para el estudio y la investigación de esta patología, con el objetivo de mejorar el diagnóstico temprano y establecer planteamientos terapéuticos en esta población. La estrategia pasa por el estudio de la epidemiología, de los posibles factores de riesgo y de la etiología del ictus pediátrico. Destaca la necesaria colaboración de los neurólogos infantiles para conseguir un mayor conocimiento de esta afección, con el fin de facilitar la toma de decisiones y poder llevar a cabo estudios y ensayos terapéuticos multicéntricos (https://www.senep.es/#grupostrabajo). La creación de un «código ictus pediátrico» ya es una realidad y se está implantando en algunos hospitales de la red nacional9–11.
CLASIFICACIÓN SEGÚN LA FISIOPATOLOGÍA Y LA EDAD DEL NIÑO
Podemos clasificar estas enfermedades neurovasculares según la fisiopatología y la edad del niño (Tabla 1).
TABLA 1. Clasificación de las enfermedades vasculares cerebrales en los niños según su fisiopatología y la edad
| Enfermedades relacionadas con eventos vasculares cerebrales en niños | Manifestaciones clínicas | Incidencia | Mortalidad | Estrategias terapéuticas |
|---|---|---|---|---|
| Isquemia global12 | ||||
| Encefalopatía hipóxico-isquémica neonatal | – Hipoxemia, hipercapnia, acidosis metabólica, parálisis cerebral (20%) – Secuelas a largo plazo |
1-8 a 25/1000 | 25-50% | – Hipotermia terapéutica |
| Isquemia/hemorragia localizada (ictus) | ||||
| Ictus perinatal (semana 20 de gestación a 28 días posparto) | ||||
| Ictus isquémico12–14 | ||||
| Arterial | – Convulsiones (72%), parálisis cerebral (26-68%) | 5 a 43/100.000 | 2% | – Sin definir |
| Trombosis venosa cerebral | – Convulsiones, alteraciones de la consciencia | 2,6/100.000 | 2-19% | – Tratados con anticoagulación |
| Ictus hemorrágico15–17 | – Encefalopatía, convulsiones, hipotonía, debilidad focal | 0,1-16/100.000 | 13-25% | – Corregir trombopenia o deficiencias de factores de la coagulación |
| Ictus posnatal (28 días posnatal a 15-19 años) | ||||
| Ictus isquémico18,19 | ||||
| Arterial | – Cefalea (20-50%), alteración del estado mental (17-38%), convulsiones (15-25% en niños < 6 años) | 1,2/100.000 | 7-28% | – Terapias de reperfusión en el ictus arterial Anticoagulación en trombosis venosa |
| Trombosis venosa cerebral | ||||
| Ictus hemorrágico19,20 | – Cefaleas/alteración del nivel de consciencia | 1,7/100.000 | 6-54% | Sin definir |
Isquemia global
La encefalopatía hipóxico-isquémica (EHI) neonatal es una patología neurovascular que ocurre durante el periodo prenatal, intraparto o posnatal. Está causada por un flujo inadecuado de oxígeno al cerebro del bebé como consecuencia de un episodio hipóxico-isquémico. Es una de las complicaciones más graves que tienen lugar durante el parto que afecta a los recién nacidos a término y requiere ventilación asistida21. Presenta una alta tasa de mortalidad, dado que alrededor del 60% de los niños que presenten EHI morirán o presentarán secuelas graves (retraso mental, epilepsia, parálisis cerebral) alrededor de los 2 años22.
La incidencia de EHI sigue siendo muy alta (1-3 casos/1000 nacidos vivos en los países desarrollados y 1-8 casos/1000 nacidos vivos en los países en vías de desarrollo) a pesar de los numerosos avances en el campo de la medicina obstétrica23. La única terapia efectiva hasta la fecha es la hipotermia terapéutica, aprobada por la Food and Drug Administration (FDA) de los Estados Unidos. A pesar de recibir este tratamiento, los niños con EHI moderada o grave siguen presentando complicaciones importantes, con una mortalidad del 28%, parálisis cerebral en el 22% y retraso cognitivo en el 24%, entre otras23.
La evaluación inicial incluye una combinación de pruebas clínicas y bioquímicas, que van a determinar si un niño es candidato para recibir hipotermia terapéutica. Se analizan los antecedentes del recién nacido (edad gestacional ≥ 36 semanas, peso al nacimiento ≥ 1800 g, momento de inicio de la hipotermia ≤ 6 horas), las puntuaciones del test de Apgar (≤ 5 a los 5 minutos), el examen neurológico para determinar evidencia de encefalopatía de moderada a grave (escala de Sarnat modificada), el equilibrio ácido-base para detectar acidosis metabólica (pH ≤ 7 o déficit de base ≥ 16 mmol/l; su valor se correlaciona con la gravedad de la lesión cerebral) y otras pruebas de laboratorio para determinar si hay un daño secundario (elevación de las transaminasas hepáticas, coagulopatía y valores elevados de troponina cardiaca I)24,25.
También es ampliamente usada la escala de Thompson para determinar el tratamiento mediante hipotermia. Presenta un alto valor predictivo para los eventos adversos y ofrece una evaluación más precisa que el examen de Sarnat modificado24.
Isquemia o hemorragia localizada (ictus)
Un ictus es una lesión cerebral focal, a diferencia de la EHI, que es global. El ictus es dependiente de la edad del niño y, según la naturaleza de la lesión cerebral, puede ser isquémico o hemorrágico.
Ictus perinatal
Tiene lugar entre la semana 20 de gestación y los 28 días posparto26. Es la primera causa de hemiparesia en la infancia. Según su etiología puede ser isquémico o hemorrágico, y según la edad del niño se subdivide en:
- Ictus fetal: entre la semana 20 de gestación y el nacimiento.
- Ictus neonatal: desde el parto hasta los 28 días de vida.
- Ictus presumiblemente perinatal: ictus diagnosticado después del periodo perinatal mediante neuroimagen, pero que se presume que ocurrió durante dicho periodo.
Dentro de los numerosos factores de riesgo que presenta esta patología, los más importantes y que ocurren con mayor frecuencia son las arteriopatías cerebrales, seguidas de las cardiopatías congénitas y adquiridas las enfermedades sistémicas y metabólicas, los traumatismos y las intoxicaciones, las infecciones, factores maternos y obstétricos, y la patología placentaria27,28. Se cree que el lado fetal de la placenta es el origen más frecuente de los émbolos, los cuales alcanzan la circulación arterial aórtica debido a que las características de la circulación fetal y neonatal precoz permiten obviar el filtro pulmonar y hepático29.
El ictus isquémico perinatal es una afección infradiagnosticada, dado que solo la mitad de los casos son sintomáticos durante el periodo neonatal. Una gran parte de ellos se detectarán por anomalías posteriores del neurodesarrollo, diagnosticándose casi siempre después de que el paciente cumpla 1 año. Un diagnóstico precoz del ictus perinatal puede reducir las complicaciones neurológicas agudas (convulsiones, hipertensión intracraneal, etc.), así como la discapacidad crónica30.
No hay evidencias del uso de terapias hiperagudas (trombólisis intravenosa o trombectomía) para neonatos con obstrucción arterial, dada la fragilidad de los vasos sanguíneos en los menores de 1 año31. Por lo tanto, es de gran importancia proporcionar medidas neuroprotectoras que tienen la finalidad de disminuir el daño asociado a la inmunomodulación y, con ello, mejorar el pronóstico clínico4.
La hemorragia intraventricular de matriz germinal es la forma más frecuente de hemorragia intracraneal en los niños prematuros (peso < 1500 g). Dada su etiopatogenia es considerada una condición diferenciada del ictus hemorrágico32.
Ictus posnatal
Tiene lugar entre los 28 días y los 15-19 años. Según su fisiopatología, se divide en ictus isquémico (50%) o hemorrágico (50%).
La clínica de un ictus posnatal puede variar según la edad del paciente. En los niños mayores suele cursar con déficit neurológico focal, sobre todo motor, con paresia de un miembro o un hemicuerpo y con o sin afasia. En los niños menores de 2 años es más inespecífica; es frecuente el inicio con crisis epilépticas o con disminución del nivel de consciencia33. Además, existe una asociación entre el ictus pediátrico y el déficit de atención por hiperactividad y el autismo34.
Para evaluar la recuperación neurológica tras un ictus pediátrico se han elaborado numerosas escalas, pero las únicas validadas para este rango de edad son la escala PSOM (Pediatric Stroke Outcome Measure), el cuestionario psRRQ (Pediatric Stroke Recurrence and Recovery Questionnaire) y la escala PSQLM (Pediatric Stroke Quality of Life Measure)35.
La principal diferencia con el adulto es que pueden presentar síntomas o signos inespecíficos, y las pruebas de imagen, como la resonancia magnética (RM), no siempre están disponibles. Como ya se ha descrito, es una patología infradiagnosticada y con un diagnóstico tardío, por lo que las opciones terapéuticas son escasas36.
En el ictus isquémico arterial, la principal causa son las arteriopatías no ateroescleróticas, siendo frecuentes también las vasculopatías, las causas cardioembólicas y las disecciones34,37.
Las hemorragias cerebrales suponen más del 50% de los ictus pediátricos. La tasa de mortalidad en los niños que han sufrido un ictus hemorrágico es más alta que en el isquémico y no hay un tratamiento claramente definido38. La principal causa son las malformaciones arteriovenosas cerebrales, seguidas de las coagulopatías sistémicas y otras lesiones vasculares cerebrales localizadas (malformaciones cavernosas, aneurismas o vascularidad tumoral)34,39.
En una revisión reciente se han descrito los avances más significativos en el tratamiento de los niños con ictus isquémico8: el empleo de medidas neuroprotectoras específicas en las fases iniciales y el incremento en el uso de terapias de reperfusión en el ictus isquémico arterial pediátrico. Se ha demostrado que la fibrinólisis con alteplasa es segura en los niños con ictus isquémico arterial administrada en un tiempo ≤ 4,5 horas desde el inicio de los síntomas. Igualmente, la trombectomía en los niños con oclusión de gran vaso mejora el pronóstico funcional. Se han publicado algunas series en pacientes menores de 2 años en las que se ampliaron la ventana terapéutica y la edad de aplicación de la fibrinólisis intravenosa, pero es algo que no aparece en las guías40,41. Hasta ahora, la trombectomía mecánica estaba limitada por la dificultad técnica en la etapa infantil, pero un metaanálisis ha demostrado la seguridad de la técnica por encima del año de edad en centros especializados y con experiencia42.
Las áreas que más se están estudiando actualmente se enfocan en determinar la dosificación eficaz de los agentes trombolíticos, la optimización de los criterios de selección para realizar la trombectomía y la búsqueda de biomarcadores que ayuden a identificar el tratamiento óptimo para cada paciente8.
CÓDIGO ICTUS PEDIÁTRICO: CRITERIOS DE ACTIVACIÓN Y ACTUACIÓN
Signos de alarma
Según la edad del paciente, la clínica del ictus pediátrico puede variar. En los menores de 2 años es muy inespecífica, siendo frecuentes las crisis epilépticas o la disminución del nivel de consciencia al inicio. Por el contrario, en los niños mayores suele cursar con déficit neurológico focal, sobre todo motor, con paresia de un miembro o de un hemicuerpo y con o sin afasia33.
Los siguientes síntomas o signos de inicio brusco en las últimas 24 horas deben poner en alerta a los profesionales sanitarios9–11:
- Crisis focales repetidas de más de 1 hora de duración en niños no epilépticos o con déficit focal (cara-brazo o cara-brazo-pierna).
- Alteraciones agudas en el habla, que generan un lenguaje incoherente o disartria.
- Alteraciones visuales bruscas en uno o ambos ojos. Lo más frecuente es la hemianopsia (defecto del campo visual). También puede producirse una desviación oculocefálica, que va dirigida hacia el lado de la lesión en los ictus supratentoriales y hacia el lado sano en los infratentoriales.
- Hemiplejia o hemiparesia de inicio brusco o progresivo.
- Alteraciones en la marcha e inestabilidad.
- Alteraciones repentinas de pares craneales: diplopía (visión doble), disfagia (dificultad para tragar), paresia facial o hipoestesia trigeminal.
- Trastorno sensorial agudo que cursa con hipoestesia (acorchamiento) o parestesia (hormigueo).
- Cefalea intensa asociada a vómitos.
- Movimientos extrapiramidales en un hemicuerpo de inicio brusco.
- Alteraciones en el nivel de consciencia.
Conviene dedicar una atención especial a los niños con las siguientes enfermedades: cardiopatías congénitas o adquiridas, drepanocitosis, diátesis hemorrágica o trombótica, tumores o tratamientos con quimioterapia, y traumatismos cervicales o craneales.
Criterios de activación
La población diana hacia la que se dirige son los niños con edades comprendidas entre 0 y 14 años. En el rango de 0-2 años no está indicado realizar el tratamiento con fibrinólisis intravenosa. Según los últimos estudios publicados, existe evidencia de trombectomía en mayores de 1 año en centros especializados42. Es importante realizar un diagnóstico diferencial previo para descartar los stroke mimics (Tabla 2), muy frecuentes en la edad pediátrica.
TABLA 2. Diagnóstico diferencial en el ictus pediátrico
| Stroke mimics «no benignos» | Stroke mimics< «benignos» |
|---|---|
| Cerebelitis | Crisis focales |
| Edema hemisférico (diabetes, hiperamoniemia) | Hipoglucemia |
| Hemiplejia alternante | Migraña con aura |
| Encefalomielitis aguda diseminada | Parálisis facial |
| Encefalopatía posterior reversible | Origen psicógeno/funcional |
| Infecciones del sistema nervioso central (meningitis, encefalitis, etc.) | Síncopes |
| Migraña hemipléjica familiar | |
| Neurotoxicidad (quimioterapia/radioterapia) | |
| Tumores |
Para proceder a la activación del código ictus pediátrico hay que considerar los siguientes aspectos:
- Tiempo de evolución de los síntomas: deben haber transcurrido menos de 6 horas desde el evento, o menos de 24 horas si se cumple alguno de los signos de alarma descritos en el apartado anterior. El inicio de los síntomas se considera desde que se vio al niño normal. En caso de que sea un ictus del despertar, el tiempo de inicio debe considerarse desde que se vio al niño en condiciones normales antes de acostarse.
- Gravedad que producen los síntomas: solo se activará en aquellos casos en que la focalidad neurológica sea aguda e incapacitante, con una puntuación en la Pediatric National Institutes of Health Stroke Scale (PedNIHSS) ≥ 6 y < 25. Si la clínica es incapacitante, se activarán también aquellos casos con PedNIHSS < 6.
- Situación de dependencia previa: para proceder a la activación debe presentar una situación basal con ausencia de déficit neurológico, que no le limitara las actividades cotidianas asociadas a su edad. Se excluirá la presencia de enfermedad avanzada cuya situación clínica sea irreversible. En este apartado se consensuará con la familia cuál era la calidad de vida del niño previa al ictus.
Protocolo del código ictus pediátrico
El tiempo es vital en los pacientes pediátricos: no deben de transcurrir más de 10 minutos para la valoración inicial por el pediatra desde su llegada a urgencias. Las pruebas de imagen deben realizarse en un tiempo inferior a 45 minutos. En caso de terapia con fibrinólisis, debe iniciarse antes de 1 hora desde la llegada del paciente a urgencias, y en caso de trombectomía mecánica, el tiempo desde la prueba de imagen hasta la punción arterial debe ser inferior a 90 minutos (Fig. 1).
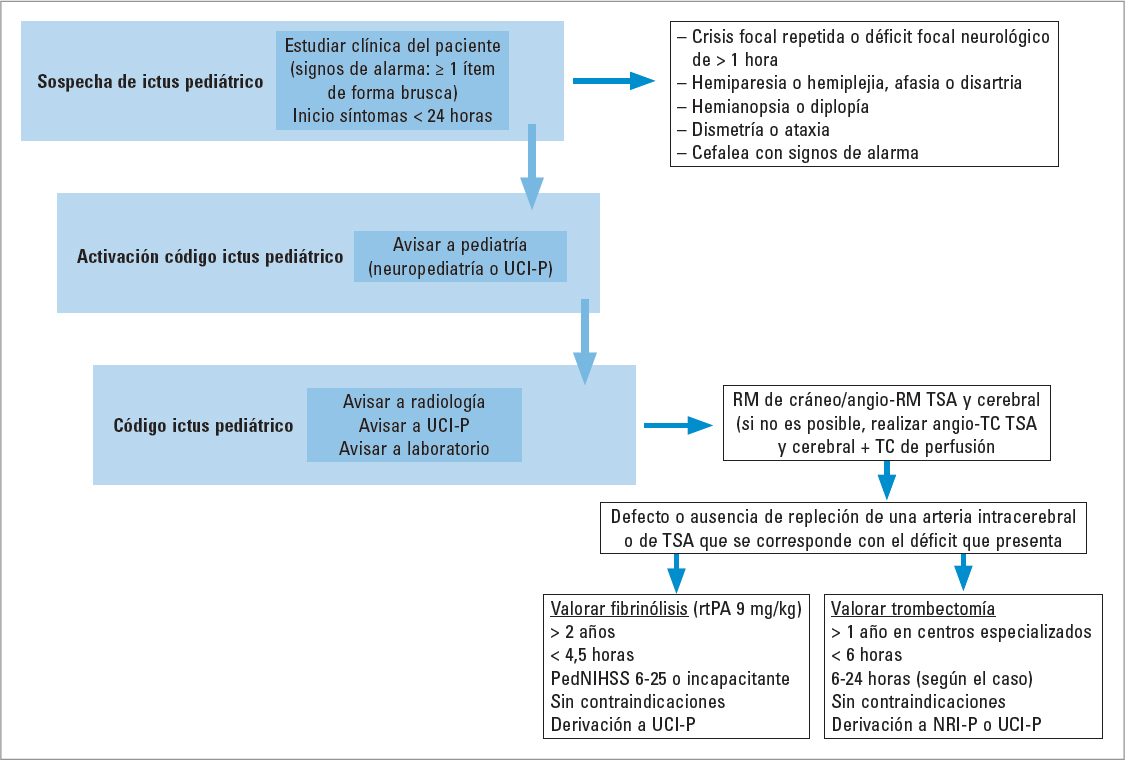
FIGURA 1. Protocolo de actuación en el código ictus pediátrico (adaptada de Protocolo Ictus Pediátrico. HUVM 20219). NRI-P: neurorradiología intervencionista pediátrica; PedNIHSS: Pediatric National Institutes of Health Stroke Scale; RM: resonancia magnética; rtPA: activador tisular del plasminógeno recombinante; TC: tomografía computarizada; TSA: troncos supraaórticos; UCI-P: unidad de cuidados intensivos pediátricos.
ESTUDIO ETIOLÓGICO. ALGORITMOS DE ACTUACIÓN
El diagnóstico de ictus es principalmente por neuroimagen. Es posible que las lesiones no se visualicen mediante tomografía computarizada en el momento del evento. La técnica de elección es la RM de cráneo, siempre que no exista ninguna contraindicación para su realización. Además, para determinar la etiología del ictus es necesario llevar a cabo una serie de estudios complementarios.
Ictus isquémico
- Estudio de vasos sanguíneos: Doppler, angio-RM, angiografía convencional.
- Estudio cardiaco: electrocardiograma, ecocardiografía.
- Analítica general: hemograma, coagulación, bioquímica con perfil hepático y renal, tóxicos en orina.
- Panel infeccioso.
- Estudio de vasculitis.
- En la fase aguda: estudio del líquido cefalorraquídeo para cribado de infecciones.
- Estudio metabólico: aminoácidos y ácidos orgánicos en orina; láctico, pirúvico, amoniaco, aminoácidos, estudios enzimáticos específicos (enfermedad de Fabry, MELAS [Mitochondrial myopathy, Encephalopathy, Lactic Acidosis and Stroke-like episodes], etc.).
Ictus hemorrágico
- Estudio de vasos sanguíneos: angio-RM, angiografía.
- Analítica general: hemograma, coagulación, bioquímica con perfil hepático y renal, tóxicos en orina.
- Panel infeccioso.
- Estudio de vasculitis.
Debe valorarse la realización de paneles genéticos en aquellos casos en que no se haya obtenido un diagnóstico claro tras la realización de los estudios complementarios descritos, presenten un ictus de pequeño vaso o haya antecedentes familiares (Tabla 3).
TABLA 3. Paneles de genes según el patrón de herencia
| Autosómico dominante | Autosómico recesivo | – NOTCH3 “CADASIL” (isq)
– COL4A1 “HANAC; BSVD” (isq/hem) – COL4A2 “POREN2” (isq/hem) – ACTA2 “enfermedad de moyamoya” (isq/hem) – APP “angiopatía amiloide cerebral” (hem) – COL3A1 “síndrome de Ehlers-Danlos tipo vascular” (hem) – CST3 “angiopatía amiloide cerebral” (hem) – ENG “HHT1” (hem) – SMAD4 “JPHT“ (hem) – TTR “amiloidosis hereditaria relacionada con transtiretina” (hem) – NF1 “neurofibromatosis tipo 1” (hem) – ACVRL1 “HHT2” (hem) – KRIT1 “malformaciones cavernomatosas cerebrales-1” (hem) – CCM2 “malformaciones cavernomatosas cerebrales-1” (hem) – PDCD10 “malformaciones cavernomatosas cerebrales-1” (hem) |
– PMM2 “CDG1A” (isq)
– SAMHD1 “AGS5” (isq) – CECR1 “poliarteritis nodosa de inicio infantil” (isq) – HTRA1 “CARASIL” (isq) – GUCY1A3 “moyamoya con acalasia” (isq y hem) – ABCC6 “pseudoxantoma elástico” (hem) – F7 “deficiencia de Factor VII” (hem) |
|---|---|
| Ligado a X | |
| – GLA “enfermedad de Fabry” (isq) | |
| Mitocondrial | |
| – MELAS (isq) | |
| Autosómico dominante/Autosómico recesivo | |
| – TREX1 “AGS1” (isq) | |
|
Se indica la enfermedad asociada al gen y el tipo de ictus: isquémico (isq) o hemorrágico (hem). CARASIL: Cerebral Autosomal Recessive Arteriopathy with Subcortical Infarcts and Leukoencephalopathy; MELAS: Mitochondrial myopathy, Encephalopathy, Lactic Acidosis and Stroke-like episodes. Adaptada de Protocolo Ictus Pediátrico. HUVM 20219. |
|
Grossi et al.43 describieron en 2020, por primera vez, un panel de genes con la intención de establecer un enfoque por etapas en niños con ictus isquémico idiopático. Aplicaron un panel de genes dirigido, seguido de secuenciación del exoma completo (WES), y puntualmente de secuenciación del genoma completo en casos más complejos. En otros estudios se destaca que los pacientes pediátricos con historia de ictus, especialmente los menores de 1 año, se beneficiarían de estudios WES, con una mayor tasa diagnóstica44.
BIOMARCADORES EN EL ICTUS PEDIÁTRICO
En la búsqueda de biomarcadores en esta población hay que considerar diferentes variables, como son el tipo de fluido (método invasivo o no invasivo), el volumen de la muestra (puede ser limitado), la capacidad de extracción, la naturaleza bioquímica del biomarcador (proteína, metabolito, micro-RNA, etc.), la capacidad de predicción del daño y de la localización de la lesión, la posibilidad de monitorizar la progresión de la enfermedad, la reproducibilidad del método empleado (kits comerciales) y la disponibilidad de valores de referencia en población pediátrica. El biomarcador ideal debería ofrecer una alternativa real en aquellos casos en los que las exploraciones clínica y radiológica sean silentes. Dadas la complejidad y la heterogeneidad del ictus pediátrico, lo idóneo sería disponer de un panel de biomarcadores45.
La variedad de las complicaciones neurológicas en el periodo perinatal, el pequeño tamaño de las cohortes en los estudios, la falta de investigaciones multicéntricas, las diferentes técnicas de evaluación de biomarcadores, así como la falta de consenso para la validación de ensayos en fluidos biológicos como orina y saliva, limitan la evaluación y la validación de biomarcadores de ictus pediátrico. La mayoría de los estudios de biomarcadores en enfermedades neurovasculares pediátricas se centran en la EHI46.
Se han descrito diversos biomarcadores. Algunos de ellos están relacionados con el tejido nervioso: S100B (proteína S100 de unión al calcio), NSE (enolasa neuronal específica), CPK-BB (creatina fosfocinasa BB), GFAP (proteína ácida fibrilar glial), MBP (proteína básica de mielina), UCHL-1 (ubiquitina carboxiterminal hidrolasa L1), activina A, proteína tau y NfL (cadena ligera de neurofilamentos); relacionados con el sistema neurovascular: VEGF (factor de crecimiento endotelial vascular), AM (adrenomedulina) y secretoneurina; con la inflamación: IL6 (interleucina-6); y otros: LDH (lactato deshidrogenasa) y acilcarnitinas46. Se han propuesto algunas combinaciones de biomarcadores, como S100B y NSE, que permitirían mostrar diferentes alteraciones de lesión cerebral, potenciando así la detección precoz de daño neuronal47.
Algunos de los biomarcadores más prometedores en esta área, que además se ajustan a los criterios de la FDA y la Agencia Europea de Medicamentos (EMA), son S100B, AM, activina A, NSE, GFAP, biomarcadores de estrés oxidativo, GFAP y UCH-L1. Son necesarias futuras investigaciones para que estos biomarcadores sean aprobados por la FDA y la EMA tras cumplir todos los requisitos declarados y puedan incluirse en las guías clínicas48.
En la tabla 4 se detallan los biomarcadores séricos registrados en revisiones publicadas recientemente y que se han descrito en varios artículos46–48.
TABLA 4. Biomarcadores séricos relacionados con daño vascular cerebral en los niños
| Biomarcador sérico | Descripción | Ref. | Patrón de daño cerebral |
|---|---|---|---|
| S100B (proteína S100 de unión al calcio) | – Proteína fijadora del calcio en los tejidos nerviosos, específica de la glía del sistema nervioso | 46-48 | Elevada en EHI y HIV |
| – Biomarcador de respuesta temprana al daño metabólico | |||
| NSE (enolasa neuronal específica) | – Isoenzima glucolítica dimérica expresada en neuronas, glóbulos rojos, hígado, músculo liso y linfocitos | 46-48 | Elevada en EHI |
| – Biomarcador de muerte neuronal | |||
| Activina A | – Miembro de la superfamilia del factor de crecimiento transformante beta | 46-48 | Elevada en EHI, HIV e ictus isquémico |
| – Regula la diferenciación y la proliferación de neuronas | |||
| – Factor neuroprotector durante el daño cerebral y el daño hipóxico-isquémico | |||
| GFAP (proteína ácida fibrilar glial) | – Proteína del filamento intermedio del citoesqueleto, localizada en la astroglía | 46,48 | Elevada en EHI e ictus isquémico |
| – Biomarcador de detección de daño cerebral isquémico | |||
| UCHL-1 (ubiquitina carboxiterminal hidrolasa L1) | – Enzima citoplasmática específica de las neuronas, localizada en las dendritas | 46,48 | Elevada en EHI |
| – Biomarcador de apoptosis neuronal | |||
| AM (adrenomedulina) | – Péptido vasodilatador implicado en la activación de la neovascularización, identificado en varios tejidos, incluido el sistema nervioso central | 46,48 | Elevada en HIV e ictus isquémico |
| – Se incrementa en estados de inflamación e hipoxia | |||
| Citocinas | – La microglía genera un exceso de citocinas inflamatorias (factor de necrosis tumoral alfa, interleucinas 6 y 1b) que pueden dañar la sustancia blanca en desarrollo al inducir coagulación intravascular o trombosis y vasoconstricción | 46,47 | Elevadas en EHI y HIV |
| Biomarcadores de estrés oxidativo | – F2-isoprostanos: biomarcador de peroxidación lipídica | 47,48 | Elevados en ictus isquémico |
| – La sustancia blanca prematura es vulnerable a lesiones mediadas por la peroxidación lipídica | |||
|
EHI: encefalopatía hipóxico-isquémica; HIV: hemorragia intraventricular. Adaptado de Menéndez-Valladares P. et al., 2020 46, Perrone S. et al., 2023 47 y Bersani I. et al., 2020 48. |
|||
CONCLUSIONES
El diagnóstico precoz contribuye a disminuir las complicaciones neurológicas agudas, así como la discapacidad crónica, en los ictus pediátricos. El trabajo multidisciplinario y coordinado es esencial para desarrollar e implantar con éxito algoritmos de «código ictus pediátrico».
El hallazgo y la validación de biomarcadores (preferentemente por métodos no invasivos) en pacientes pediátricos ayudaría en el diagnóstico, permitiendo una identificación temprana y promoviendo tratamientos preventivos o terapéuticos específicos. Dada la complejidad de la etiología del daño cerebral en esta población, la incertidumbre sobre el momento de la lesión y la dificultad en la toma de muestras, su validación para la implantación en la práctica clínica está limitada.
Sería de gran utilidad diagnóstica poder disponer de un panel de biomarcadores inflamatorios y neuronales, como S100B, en combinación con otros.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca ni apoyo de un programa de investigación destinado a la redacción de su contenido.
CONFLICTO DE INTERESES
Los autores no comunican conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
Los autores declaran que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este trabajo no aparecen datos de pacientes.
Uso de inteligencia artificial generativa
Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni en la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.