INTRODUCCIÓN
Las alteraciones cognitivas son frecuentes en numerosas enfermedades neurológicas y también en enfermedades psiquiátricas y sistémicas1. En algunas enfermedades, dichas alteraciones cognitivas constituyen el síntoma principal de inicio. Entre estas destaca la enfermedad de Alzheimer, que es la principal causa de demencia. Sin embargo, también son frecuentes otras enfermedades neurodegenerativas, como la degeneración frontotemporal y la demencia con cuerpos de Lewy. Aunque estas enfermedades tienen bases anatomopatológicas y fisiopatológicas diferentes, el diagnóstico diferencial desde el punto de vista clínico con frecuencia es difícil, especialmente en sus estadios precoces. Asimismo, en cada una de estas enfermedades los cuadros clínicos y el pronóstico son heterogéneos, y las pruebas diagnósticas disponibles (clínicas, analíticas, de neuroimagen, etc.) no son totalmente sensibles y específicas. Y, además, en fases precoces, la distinción entre síntomas cognitivos debidos a una enfermedad neurodegenerativa incipiente y síntomas cognitivos asociados al envejecimiento normal o a causas no neurodegenerativas también puede resultar difícil. Todas estas dificultades diagnósticas se suman a la falta de tratamientos eficaces que modifiquen el curso de estas enfermedades, las cuales suponen una elevada discapacidad y un gran impacto en la calidad de vida de los pacientes y de sus familiares2,3.
El uso de la inteligencia artificial (IA) puede suponer avances relevantes en el campo de la biomedicina4. Mediante el uso de técnicas de machine learning y deep learning pueden desarrollarse algoritmos para obtener unas adecuadas clasificación y categorización de los pacientes a partir de la integración de datos complejos o de múltiples orígenes. Potencialmente, este abordaje puede emplearse con el fin de establecer un diagnóstico apoyado por ordenador (computer-aided diagnosis) con el que automatizar o acelerar procesos de análisis y poder extraer mayor información. Una de las ventajas del machine learning es la posibilidad de generar modelos predictivos que permiten hacer generalizaciones a partir de los datos disponibles y el aprendizaje que sobre estos datos se genera. Estos modelos pueden clasificarse en supervisados y no supervisados. En el primer caso, se persigue lograr una clasificación correcta (modelos de clasificación; por ejemplo, diagnóstico de enfermedad de Alzheimer respecto a otros diagnósticos) o estimar el valor de una variable (modelos de regresión; por ejemplo, predecir la edad de presentación de una enfermedad neurodegenerativa) a partir de una fuente de datos (por ejemplo, variables clínicas, cognitivas, de neuroimagen, etc.). En los modelos no supervisados no existe un conocimiento previo y se pretende descubrir patrones a partir de los datos; buen ejemplo de ello son las técnicas de clustering, que buscan identificar subgrupos a partir de los datos de los individuos y la similitud de las variables (por ejemplo, subtipos de una enfermedad). Respecto al deep learning, incluye un conjunto de algoritmos basados en redes neuronales artificiales con múltiples capas de procesamiento de los datos.
En este artículo se revisan algunas de las aportaciones más interesantes en el campo de la neurología cognitiva y las demencias basadas en la aplicación de la IA. El objetivo es mostrar las capacidades de este tipo de técnicas en dicho campo, en el cual, debido a las dificultades diagnósticas y terapéuticas actuales, la IA puede tener un papel relevante.
INTELIGENCIA ARTIFICIAL Y EVALUACIÓN COGNITIVA
La evaluación cognitiva es una herramienta imprescindible en el diagnóstico de las enfermedades que cursan con deterioro cognitivo, y son uno de los primeros pasos en la valoración de los pacientes. Los test cognitivos breves sirven con frecuencia de cribado en las consultas de atención primaria y de neurología general, y tienen unos valores adecuados de sensibilidad y especificidad. Asimismo, las evaluaciones neuropsicológicas pormenorizadas permiten detectar alteraciones cognitivas incipientes, determinar el estadio clínico y establecer el diagnóstico diferencial entre enfermedades neurodegenerativas. Sin embargo, existen algunas dificultades en la práctica clínica. Por un lado, el diagnóstico en estadios incipientes de las enfermedades neurodegenerativas es cada vez más relevante, lo que implica la necesidad de definir puntos de corte para considerar un rendimiento cognitivo alterado. Por otro, la necesidad de un diagnóstico más precoz implica que las alteraciones cognitivas son más sutiles y, por ello, son necesarias exploraciones más exhaustivas que consumen más tiempo del clínico. Además, la interpretación de la evaluación cognitiva es con frecuencia compleja, dado que se basa en la administración de múltiples test que no son específicos de una función cognitiva. Esto implica interpretar cuáles son las bases neurales y los mecanismos cognitivos asociados a cada test, y determinar en cada paciente qué procesos neuropsicológicos están fallando, como apoyo para el diagnóstico de una enfermedad u otra. La existencia de numerosos test cognitivos, de por sí una ventaja al brindar la posibilidad de obtener mayor información, puede suponer también una dificultad en cuanto a cuál escoger o a qué test dar más importancia en una evaluación para definir un diagnóstico o, incluso, para acortar la exploración en caso necesario. Al mismo tiempo, si bien existen datos de normalidad que permiten diagnósticos transversales, existe menos información acerca del comportamiento longitudinal de la función cognitiva y el diagnóstico neuropsicológico en estos casos5.
En este sentido, las técnicas de IA pueden tener un papel relevante6. Por ejemplo, se han generado aplicaciones basadas en redes convolucionales para segmentación de imágenes con el objetivo de puntuar y evaluar la copia de los pentágonos entrelazados de la prueba Mini-Mental State Examination o el test del reloj, con valores elevados de sensibilidad y especificidad7–9. Igualmente, la utilización de algoritmos de machine learning puede ser útil en la discriminación entre pacientes con enfermedad de Alzheimer y con demencia frontotemporal con precisiones elevadas, lo que podría ser un apoyo para la interpretación de la evaluación cognitiva y la selección del test10,11.
Por otro lado, el uso creciente de evaluaciones cognitivas computarizadas mediante test de cribado adaptados para autoadministración, baterías cognitivas (como por ejemplo CANTAB [Cambridge Neuropsychological Test. Automated Battery] o Vienna Test System) o técnicas de realidad virtual genera una cantidad ingente de datos cuyo análisis con técnicas de machine learning puede aumentar la capacidad diagnóstica de dichas pruebas12–14. De forma similar, estas técnicas también pueden permitir un análisis automatizado de la voz, el lenguaje y el habla, lo que tiene un gran interés desde el punto de vista diagnóstico15.
INTELIGENCIA ARTIFICIAL Y NEUROIMAGEN
La neuroimagen ha sido uno de los campos en los que más se han aplicado las técnicas de IA. Tanto la resonancia magnética como la tomografía por emisión de positrones, con sus diferentes secuencias y trazadores, son una aproximación in vivo a las alteraciones presentes en el cerebro de los pacientes. Una de las áreas más activas es la aplicación de deep learning y machine learning con el fin de poder generar software de detección automática de patrones o que ayuden en la interpretación radiológica e las imágenes16,17. La automatización del cálculo de volúmenes cerebrales o del metabolismo cerebral ha mostrado resultados favorables al mejorar el diagnóstico en el campo de las demencias respecto al análisis visual convencional18,19.
Asimismo, las técnicas de análisis no supervisado aplicadas a las pruebas de neuroimagen, junto con los datos clínicos, han permitido detectar subtipos de enfermedades de acuerdo con el patrón topográfico de la neurodegeneración. Todo ello contribuye a una mejor estratificación de los pacientes y un mejor conocimiento de las enfermedades, los cuadros clínicos y sus heterogeneidades. De igual forma, puede mejorar el diagnóstico y la predicción del pronóstico, y representa una oportunidad para terapias personalizadas bajo el enfoque de la medicina de precisión20–22.
Una de las limitaciones más importantes de la neuroimagen en la práctica clínica es la realización de protocolos de neuroimagen con menores tiempos de adquisición y en general con menor resolución y en dos dimensiones. Este tipo de protocolos, habitualmente realizados para un análisis visual que descarte causas secundarias de demencia, evita la posibilidad de llevar a cabo análisis más avanzados como los que se utilizan en estudios de investigación. Por ejemplo, no es posible realizar el cálculo de volúmenes cerebrales o del grosor cortical, para lo que suele ser necesario el empleo de adquisiciones 3D y con resoluciones isotrópicas de 1 mm. En este sentido, los trabajos basados en técnicas de deep learning han generado herramientas que permitirían transformar secuencias de resonancia magnética clínicas en secuencias 3D-T1 de 1 mm susceptibles de análisis morfométricos23. Al igual que se ha comentado para la evaluación cognitiva, las técnicas de IA permiten extraer más información que la obtenida habitualmente y optimizar su análisis, lo que puede incrementar las posibilidades diagnósticas.
Un buen ejemplo de la posibilidad de obtener más rendimiento en pruebas diagnósticas del que se logra mediante una lectura convencional son los estudios de electroencefalografía. Si bien el electroencefalograma es una prueba que no suele considerarse útil en el diagnóstico de las demencias, el uso de técnicas de análisis con aplicación de machine learning ha hecho replantearse el uso de esta técnica, mostrando alteraciones incluso desde estadios precoces y con diferencias entre las distintas enfermedades neurodegenerativas24–26.
INTEGRACIÓN DE DATOS MULTIDIMENSIONALES
Aunque gran parte de los estudios sobre técnicas de machine learning se han realizado con datos procedentes de una o dos técnicas, este tipo de metodología tiene especial aplicación en el análisis de datos multidimensionales procedentes de múltiples fuentes. La integración de datos clínicos, cognitivos, de neuroimagen, biomarcadores de fluidos, genéticos, de ciencias «ómicas», etc., constituye sin duda uno de los horizontes más prometedores para extraer conocimiento nuevo, generar modelos más predictivos y comprender la interrelación de las diferentes variables. Los estudios de cohortes de biomarcadores, como la Alzheimer’s Disease Neuroimaging Initiative (ADNI)27, han supuesto una fuente de datos importante para este tipo de estudios28. Además, mediante métodos de feature selection (selección de características) es posible distinguir cuáles son las variables más importantes o discriminativas en los modelos entrenados, lo que tiene gran importancia desde el punto de vista clínico, donde habitualmente la disponibilidad de información es más limitada. Este abordaje es en especial interesante en el ámbito de la genómica y de otras «ómicas» (proteómica, transcriptómica, lipidómica, etc.)29.
INTELIGENCIA ARTIFICIAL Y TERAPÉUTICA
El desarrollo de fármacos y de intervenciones terapéuticas generalmente es un proceso difícil que requiere grandes inversiones económicas y mucho tiempo desde que se desarrollan hasta que se realizan los diferentes estudios, tanto preclínicos como clínicos, para demostrar su seguridad y beneficio. En este sentido, las técnicas de IA permiten el desarrollo de tecnologías con análisis realizados por computadoras (in silico) que modelizan y simulan cohortes virtuales con las que evaluar la seguridad y la eficacia de fármacos o de dispositivos30,31. Asimismo, es posible aplicar simulaciones de cerebros virtuales de forma individualizada a cada sujeto con el fin de anticipar el efecto de terapias como la neuroestimulación, la neurorrehabilitación o las neuroquirúrgicas32.
INTERNET DE LAS COSAS Y DEMENCIA
La denominación «Internet de las cosas» (IoT, Internet of Things) suele emplearse para referirse a una serie de dispositivos que pueden manejarse de forma remota vía internet y que pueden destinarse a facilitar las actividades cotidianas. En el campo de las demencias, este tipo de dispositivos pueden emplearse para detectar riesgos o monitorizar a pacientes, pero también para ayudar a implementar terapias. Si bien el hecho de que los pacientes muestren déficits cognitivos, con frecuencia graves, es un desafío importante para la implementación y el uso de las nuevas tecnologías, las marcadas dificultades cotidianas que sufren los pacientes con demencia y sus cuidadores están estimulando la innovación y el desarrollo en este campo. Uno de los objetivos principales es intentar mantener la autonomía y la vida en el domicilio el mayor tiempo posible. En este sentido, se han desarrollado dispositivos que recuerdan el horario de las medicaciones y monitorizan las comidas y las bebidas (horario, cantidad, cantidad, etc.)33, localizadores mediante GPS para evitar la desorientación, gafas que ayudan en la identificación de personas o en la localización de objetos perdidos, etc.34. Sin embargo, son necesarios estudios de validación, ya que la mayoría de los trabajos publicados han sido principalmente descriptivos y exploratorios35.
DISCUSIÓN
Las técnicas de IA son una metodología relevante con interés y aplicaciones crecientes en el campo de la neurología cognitiva, dado que pretenden dar soluciones a las principales dificultades clínicas actuales. En este sentido, los estudios realizados sugieren que estas técnicas pueden tener notables aplicaciones con las que mejorar las capacidades diagnósticas y pronósticas actuales mediante la extracción y el análisis de información procedente de pruebas de neuroimagen, cognitivas, biomarcadores en sangre, etc., por separado y mediante la integración de múltiples datos. Si bien la neuroimagen, debido a su mayor volumen de datos, ha sido uno de los ámbitos en que más se han aplicado estas técnicas en los últimos años, existen estudios que apoyan su potencial aplicación en el resto de las pruebas diagnósticas. La IA, debidamente aplicada, puede servir para extraer y procesar más información que la habitualmente obtenida en la práctica clínica habitual mediante análisis convencionales, así como generar herramientas que sirvan de apoyo o automatización al diagnóstico. La obtención de datos, sobre todo fruto de la combinación de múltiples fuentes de información, puede lograr la generación de conocimiento nuevo, dado que estas técnicas permiten encontrar relaciones lineales y no lineales e identificar subgrupos de pacientes mediante análisis no supervisados. La posibilidad de identificar subgrupos, realizar predicciones y seleccionar las variables más relevantes de acuerdo con la pregunta clínica formulada permitirá, asimismo, una optimización, y por lo tanto un uso más eficiente, de los recursos (Fig. 1).
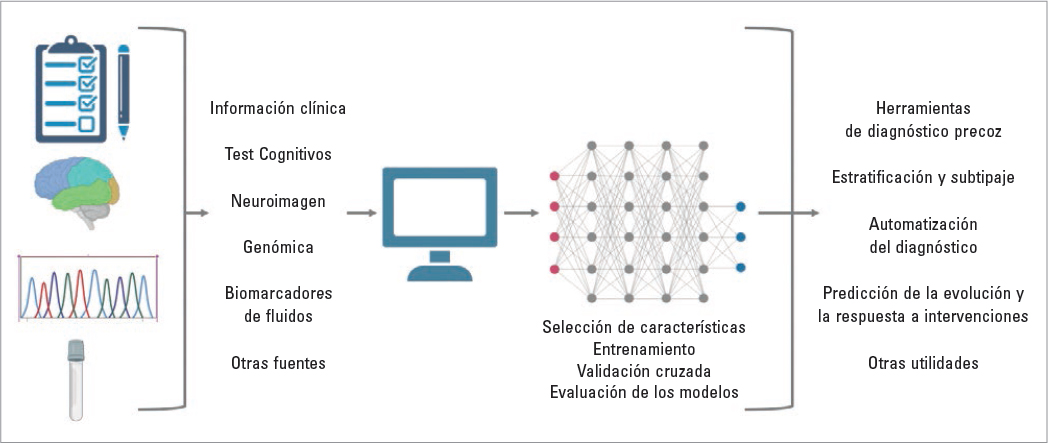
FIGURA 1. Representación esquemática del papel de la inteligencia artificial en las demencias.
Estas técnicas también pueden aplicarse al desarrollo de tratamientos o dispositivos de apoyo para las actividades de la vida diaria. Respecto a su utilidad terapéutica, la posibilidad de realizar modelizaciones virtuales abre una nueva época y una ventana de oportunidad en el desarrollo de tratamientos experimentales con los que mejorar el pronóstico de las enfermedades neurodegenerativas.
Finalmente, la implementación de la IA en el campo de la neurología cognitiva y las demencias debería aproximarnos a contemplar el diagnóstico y el tratamiento de estas enfermedades desde los nuevos paradigmas de la medicina personalizada y la medicina de precisión. Además, es probable que, debido a la complejidad y la heterogeneidad de este grupo de enfermedades, este enfoque no solo sea «beneficioso», sino una «necesidad» si se pretende cambiar su curso natural.
FINANCIACIÓN
El presente trabajo no ha recibido ninguna subvención oficial, beca o apoyo de un programa de investigación destinados a la redacción de su contenido.
CONFLICTO DE INTERESES
El autor no comunica conflicto de intereses en relación con el contenido del trabajo.
RESPONSABILIDADES ÉTICAS
Protección de personas y animales
El autor declara que para este trabajo no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
El autor declara que en este trabajo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
El autor declara que en este trabajo no aparecen datos de pacientes.